细胞命运转化是由精密复杂的信号调控和表观遗传调控所决定,其分子机理研究是细胞生物学发展亟需解决的核心问题之一。研究表明,小鼠的多能性干细胞在信号维持和功能上存在两种不同的状态,分别是始发态(primed)的上胚层干细胞(Epiblast stem cells, EpiSCs)和原始态(naive)的胚胎干细胞(Embryonic stem cells, ESCs)。在体外,这两种多能性干细胞状态可以相互转变,在ActivinA和bFGF信号的刺激下,naive态的ESCs可以分化为primed态的EpiSCs。相反,通过过表达单个naive态的多能性基因,例如Esrrb, Klf2, Nr5a2等也可实现始发态向原始态的转变(primed to naive transition, PNT)。研究小鼠PNT过程的细胞命运转变机制可以为我们分离或诱导不同物种naive态多能性干细胞提供参考意见,然而小鼠PNT的细胞命运变化过程主要的分子机制仍不明确。
2020年5月11日,中国科学院广州生物医药与健康研究院裴端卿研究组和刘晶研究组在Nature Cell Biology杂志在线发表了BMP4 Resets Mouse Epiblast Stem Cells to Naive Pluripotency through Zbtb7a/b-mediated Chromatin Remodeling的研究论文。该研究首先发现BMP4可以诱导小鼠PNT,并建立化合物成分明确的高效诱导PNT体系。随后,利用ATAC-seq等高通量测序技术,揭示小鼠PNT过程的具体分子机制。
研究人员首先发现生长因子BMP4可以诱导小鼠PNT,借助可视化的报告系统,通过化合物库筛选,发现EZH2抑制剂EPZ6438和DOT1L抑制剂EPZ5676可以显著提高诱导效率,进而建立了8天内诱导效率高达80%的化学成分明确的小鼠PNT诱导体系。
在该平台的基础上,研究人员基于染色质转座酶可及性测序(Assay for transposase-accessible chromatin with high-throughput sequencing, ATAC-seq)联合生物信息学分析,描绘了化学小分子诱导小鼠PNT过程染色质可及性动态变化规律,并发现该体系中最关键的因子BMP4通过调控染色质可及性,一方面抑制分化相关位点的开放,另一方面促进naive多能性基因位点的开放来介导PNT的进行。通过分析BMP4开放并激活表达的基因位点,研究人员发现BMP4新的下游靶点ZBTB7家族转录因子Zbtb7a和Zbtb7b通过影响染色质重塑调控PNT的功能。进一步通过染色质免疫共沉淀技术(chromatin immunoprecipitation, ChIP)证明Zbtb7a直接结合并激活Esrrb, Klf2, Nr5a2等naive多能性基因的表达,从而调控PNT的发生。
综上所述,本研究建立了高效的化学诱导小鼠PNT的技术平台,从染色质可及性角度揭示了其中的分子机理并发现新的靶点,在细胞命运转化机理研究中取得新的发现,为研究化学调控细胞命运转变提供新的理解和切入点,同时为其他研究体系例如人体系的naive态多能干细胞的获取提供了极具意义的参考方向。
裴端卿研究员和刘晶研究员为该论文的通讯作者。博士研究生余胜勇和周纯华,曹尚涛博士,何江平博士为该论文的共同第一作者。
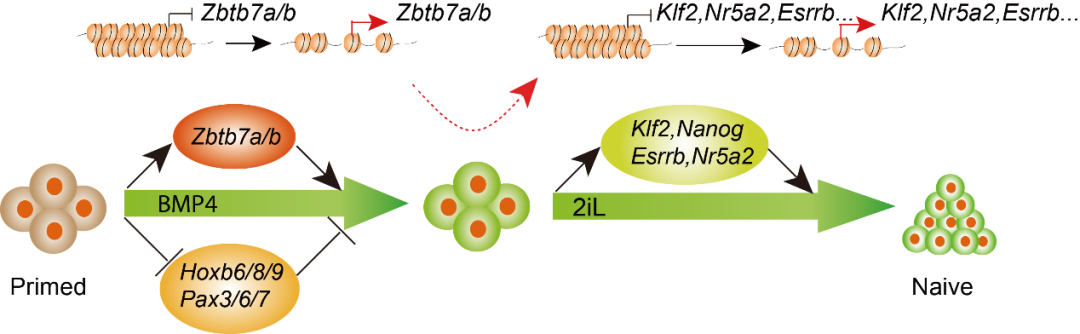
细胞命运转换过程、染色质变化以及中间参与的调控蛋白
附件下载:


