基因单核苷酸变异(SNV)与基因功能密切相关。基于日渐普及的高通量测序技术,研究人员在动植物乃至人类基因组中发现了大量的SNVs。这些细微的基因差异中的部分已经被证实与动植物的性状变异相关,也与人类遗传疾病的发生发展或药物疗效存在密切联系。但是目前仍有大量SNV的功能尚未得到明确,如何揭示这些遗传变异与物种性状及临床表型间的关联,是农业分子育种和精准医学研究等领域向前推进时亟需解决的瓶颈。
基因饱和突变文库是研究基因SNV功能的重要工具。利用基因编辑技术在基因特定区域中引入不同类型的碱基突变,并以其为基础进行功能性筛选,可以实现基因SNV功能的高通量研究。
近年来,基因突变文库构建主要借助CRISPR/Cas9系统在目标区域内引入移码突变破坏基因表达,从而根据表型鉴定基因功能。这种方式也可以诱导基因SNV的产生,但是效率极其低下,不适合用于与基因SNVs相关的饱和突变文库的高效构建。David Liu实验室开发的碱基编辑器(BE)为饱和文库的构建带来了技术上的突破。BE系统可以在基因特定区域引入高效的单碱基转换,因此被迅速应用于与DNA损伤应答或癌症相关的基因SNVs功能的高通量筛选等研究中,并取得了突破性的成果。但现有的BE只能实现一种或两种类型的碱基转换,不能满足饱和突变文库对编辑产物多样性的需求,因此,亟需建立可以诱导多种类型碱基转换的基因编辑工具。
该研究将腺嘌呤碱基编辑器(ABE)和糖苷酶碱基编辑器(CGBE)结合,开发出一种新型的双碱基编辑器——AGBE。它可以利用单个向导RNA(sgRNA)诱导同一等位基因的靶序列单独或同时发生包括A-to-G、C-to-G、C-to-T和C-to-A等4种不同类型的碱基转换。随后,研究人员在永生化细胞系、原代细胞和胚胎细胞等多个哺乳动物的细胞体系中验证了AGBE系统的有效性。结果表明,与单独的ABE和CGBE相比,AGBE极大地拓宽编辑窗口(从4-8到3-13),在此基础上通过将不同类型的碱基转换进行组合,可以大幅度地增加编辑产物的多样性,从而构建出含有更多基因突变类型的突变文库。令人惊喜的是,研究人员通过分析全基因组和转录组测序数据,发现AGBE并不会引起明显的DNA或RNA水平的脱靶效应,证明了该系统是一款高效且安全的碱基编辑工具。
研究人员挑选了人类白喉毒素受体基因hDTR用于验证AGBE在基因饱和突变文库构建中的应用潜能。当hDTR基因发生突变时,会改变人类细胞对白喉毒素的敏感性,结合白喉毒素筛选和富集,可以快速获得具有白喉毒素抗性的突变文库,从而分析hDTR基因的SNV与药物敏感性间的联系。研究结果表明,在针对hDTR基因的关键功能域设计的32条sgRNA中,有20条可以赋予细胞抵抗白喉毒素的能力,产生了多达59269种不同类型的等位基因突变产物,并从中筛选出对白喉毒素有不同敏感性的突变细胞株。以上结果充分证实了利用AGBE系统进行基因SNVs功能高通量研究的可行性和高效性。
本研究中,中国科学院广州生物医药与健康研究院赖良学课题组梁艳慧博士、谢精科博士、张全军助理研究员和王晓民博士为共同第一作者,赖良学研究员和王可品副研究员为共同通讯作者。该研究成果得到了国家自然科学基金、国家重点研发计划、广东省科技计划、中国科学院青年创新促进会和中国科协青年人才托举工程等项目的资助。
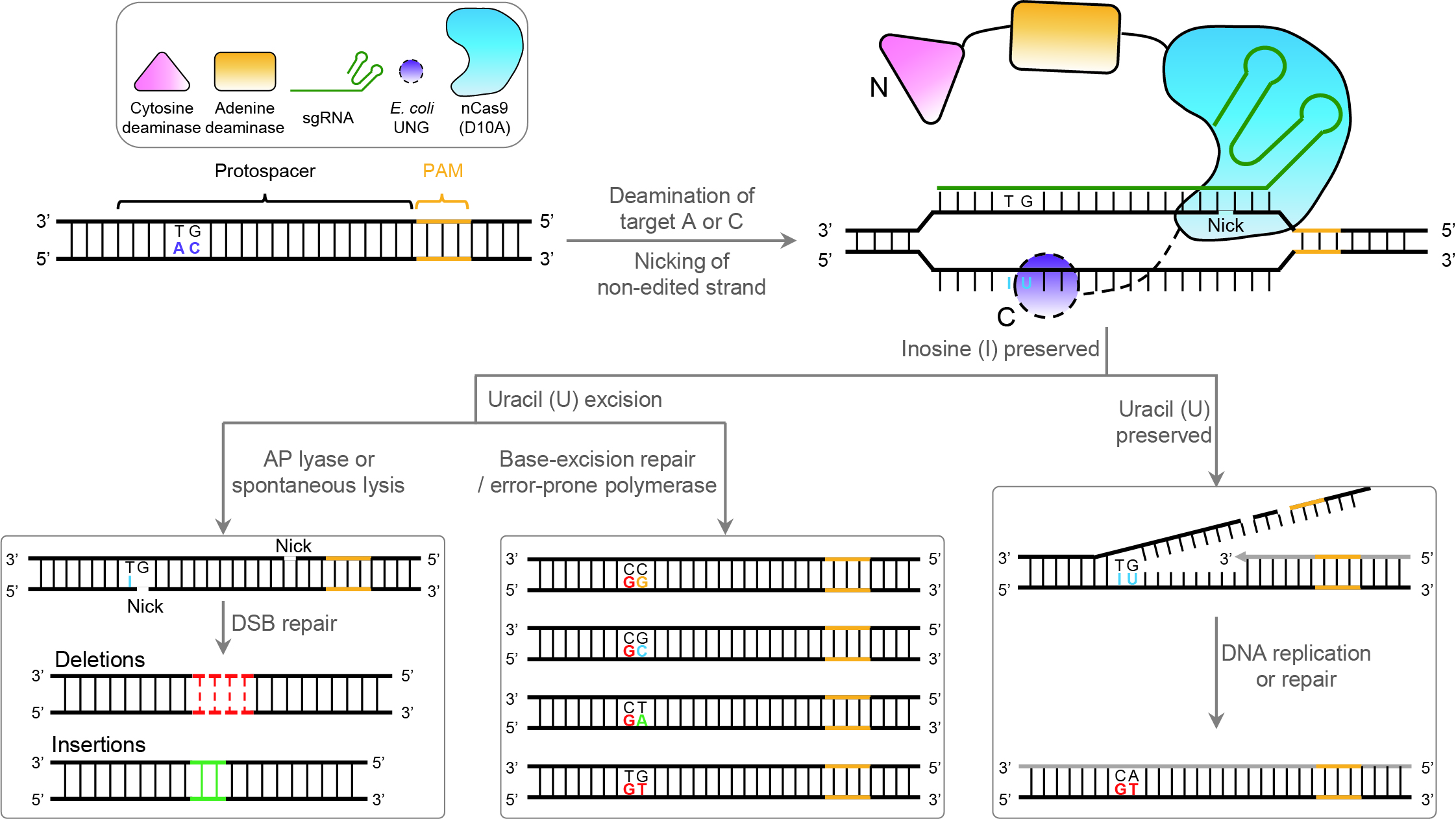
新型双碱基编辑器AGBE工作原理图
附件下载:


