5月17日,中科院广州生物医药与健康研究院王金勇课题组在Cell Proliferation在线发表了题为Hoxb5 reprogrammes murine multipotent blood progenitors into haematopoietic stem cell-like cells 的研究论文,该研究首次揭示了Hoxb5可以体内高效诱导多能造血祖细胞(MPP)重编程为具有造血干细胞样(HSC-like)的新型细胞,证明这种HSC-like的细胞可以实现在动物上三次系列移植,体内重建多谱系长期造血能力。这为开发替代传统骨髓移植细胞来源提供了新的思路。
多能造血祖细胞(Multipotent blood progenitors, MPP)由造血干细胞(Haematopoietic stem cells, HSC)分化而来,能够迅速分化产生所有成体血液谱系细胞,是维持造血稳态和应激造血的关键祖细胞。和HSC不同的是,MPP失去自我更新的能力,但增殖分化能力强大,数量也多。HSC数量稀少的问题一直是临床治疗疾病的一大障碍,因此逆分化诱导MPP快速产生新的HSC是一个快速捷径,一直是血液再生领域的研究热点之一。王金勇课题组长期研究造血谱系命运重编程和再生,前期研究发现Hoxb5可以将ProB细胞在体转分化为T细胞谱系(Zhang Mengyun, et al. Nature Immunology, 2018), Runx1和Hoxa9可以诱导多能干细胞高效分化为T细胞免疫谱系(Guo Rongqun, et al. Cell Research, 2020), Lhx2, Hoxa9和Runx1三因子组合可以诱导多能干细胞高效分化为B细胞免疫谱系(Zhang Qi et al. Cellular & Molecular Immunology, 2021)。本研究在上述工作基础上,发现在MPP细胞背景中基因工程表达外源Hoxb5转录因子,可以在动物体内诱导产生HSC-like细胞,并且分化产生整个成体造血和免疫系统。
课题组基于条件性表达Hoxb5蛋白的基因编辑小鼠模型Mx1cre/RosaLSL-Hoxb5-EGFP/+(C57BL/6背景,CD45.2株)和野生型的移植受体小鼠(C57BL/6背景,CD45.1株)完成了此项研究。首先将野生表型的MPP移植到CD45.1株的野生型小鼠中,通过多聚胞苷酸启动MPP中的Hoxb5表达,驱动细胞命运在体重编程,产生一类表型为CD11b和CD48表面标记阳性的HSC-like细胞(CD11b+CD48+SK),但天然HSC没有这种表型。CD11b+CD48+SK拥有了HSC的特性:能够和HSC一样进行自我更新;能够分化为全谱系的成体血液细胞;能够进行系列移植,在体内实现长期造血。在单细胞转录组特性上,使用UMAP对四个细胞群(天然成体HSC,天然成体MPP,胎肝HSC,CD11b+CD48+SK)进行无偏聚类分析,发现CD11b+CD48+SK保持了多能造血祖细胞的身份印记,还拥有了胎肝时期的造血干细胞部分特征,和胎肝时期的造血干细胞类似,处于旺盛的细胞增殖分裂状态。此外,该研究没有发现Hoxb5导致成瘤的证据。
中科院广州生物医药与健康研究院博士生黄德浩和中山大学医学院副研究员赵乾皓为该论文的共同第一作者。博士后胡房晓和王金勇研究员为该论文的共同通讯作者。本研究与实验血液学国家重点实验室程辉教授合作完成的。研究得到来自国家自然科学基金委和中科院前沿科学重点研究项目等项目经费支持。
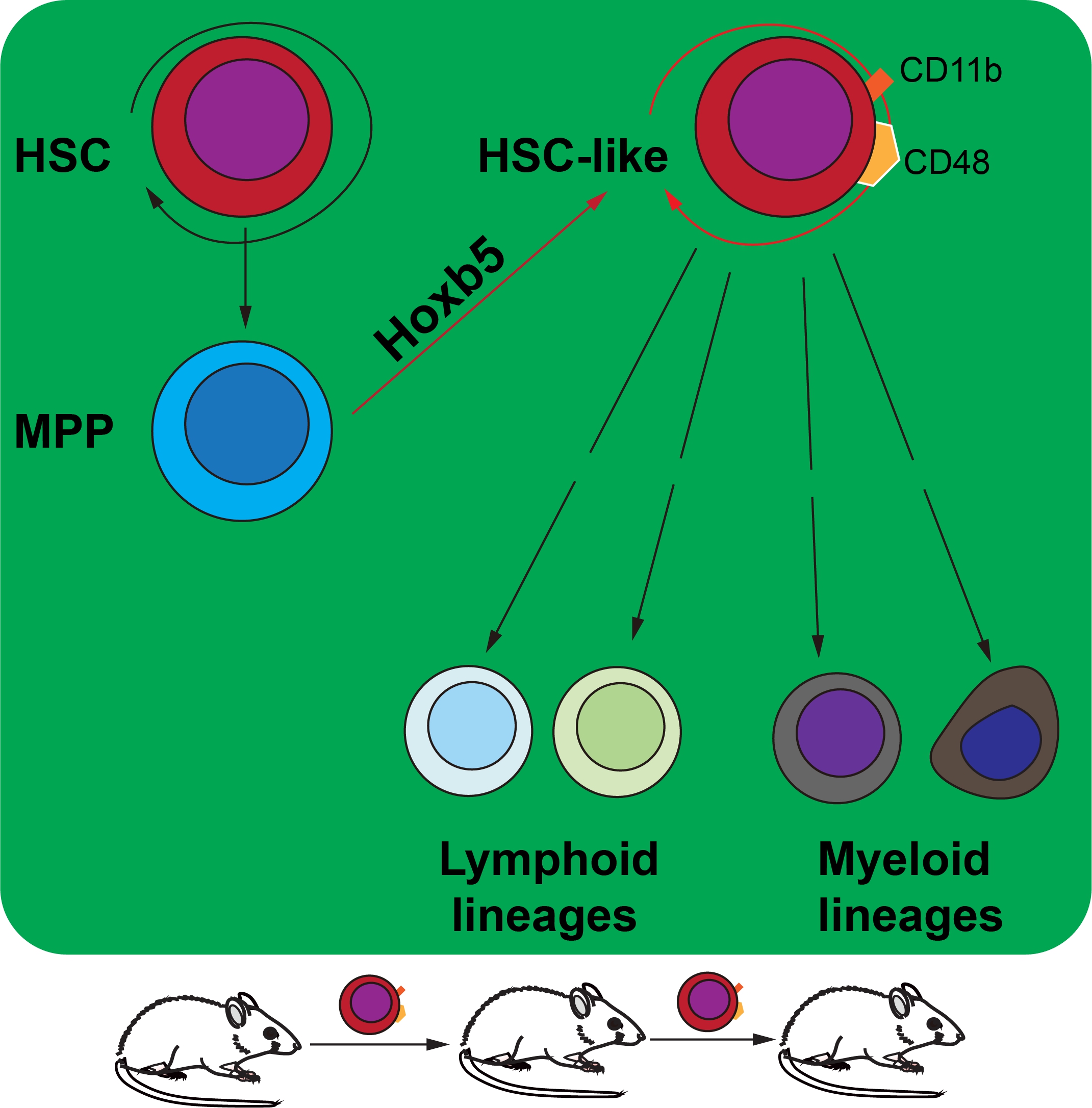
Hoxb5将MPP重编程为HSC-like 细胞
附件下载:


