随着蛋白质谱技术的发展,许多组蛋白赖氨酸残基的酰化修饰被鉴定出来,其中巴豆酰化修饰是一类在酵母、哺乳动物等真核生物中保守存在的组蛋白酰化修饰。自2011年被发现以来,巴豆酰化修饰俨然成为了领域内的研究热点。这是因为该修饰是一种重要的表观遗传机制调节基因转录的翻译后修饰。尽管巴豆酰化和乙酰化基团的化学结构类似,却可能存在不同于乙酰化修饰的生物学功能。因此,揭示不同酰化修饰在组蛋白同一位点的生物学功能差异是研究组蛋白酰化修饰的难点问题。
北京时间5月30日,北京大学药学院刘涛课题组联合中国科学院深圳先进技术研究院合成生物学研究所罗小舟课题组以及北京大学基础医学院刘小云课题组,在Angew. Chem. Int. Ed.在线发表了题为“Creation of a Yeast Strain with Co-translationally Acylated Nucleosomes”的研究论文。

文章上线截图
文章链接:https://doi.org/10.1002/anie.202205570
2002年Joseph A. Krzycki团队发表在Science上的研究工作表示,自然界中的产甲烷菌存在一套正交的翻译机器,可识别琥珀密码子(TAG),将除20种经典氨基酸以外的吡咯赖氨酸通过遗传编码的方式编码到蛋白中。因此,吡咯赖氨酸成为了古生菌中一种独特存在的共翻译修饰(Co-Translational Modification,CTM)方式。受到这一修饰方式的启发,文章以酿酒酵母为模式生物,借助基因密码子扩展(Genetic Code Expansion,GCE)技术创造出一种含有CTM核小体的酵母菌株,研究人员发现与组蛋白H3K56位点巴豆酰化共修饰相比,该菌株中组蛋白H3K56位点的乙酰化共修饰能够为酿酒酵母DNA损伤修复提供更为有利的染色质环境,且二者对其他位点翻译后修饰(Post-translational Modification,PTM)丰度的影响也存在一定的差异(图1)。该研究探索性地将定点共翻译修饰作为合成表观遗传学的研究手段,为真核生物中不同组蛋白酰化修饰生物学功能的研究提供了一种不可替代的研究方法。
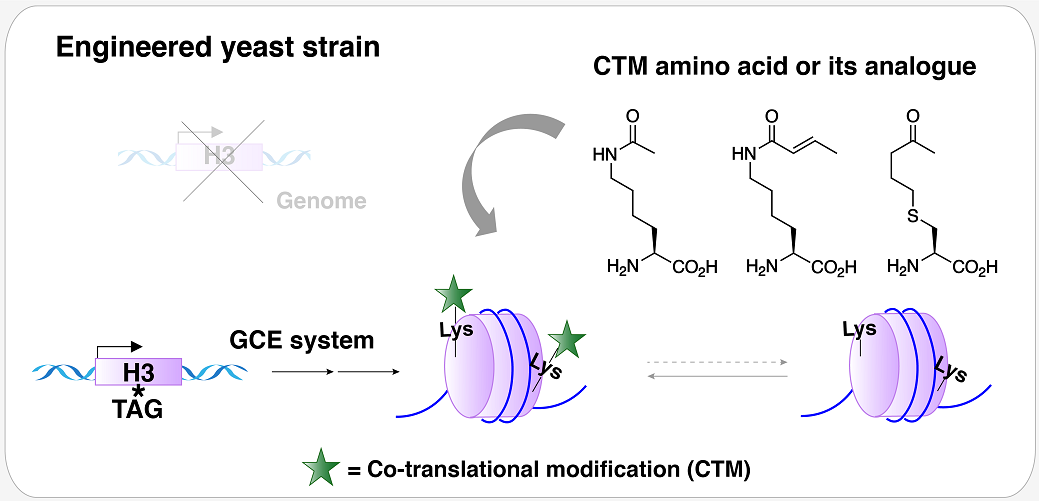
图1:含有CTM核小体的酿酒酵母菌株
基因密码子扩展技术即通过与宿主生物正交的氨酰tRNA合成酶(aminoacyl-tRNA synthetase, aaRS)/tRNA对,将非经典氨基酸(Non-canonical Amino Acid,ncAA)编码到宿主目标蛋白的特定位点上。首先,研究人员汇总了现有的酿酒酵母基因密码子扩展体系(包括PylRS和E.coli LeuRS 体系),将EGFP的荧光信号强度作为GCE体系编码效率的评估指标,并构建了一系列GCE体系,比较这些体系将乙酰赖氨酸(Acetyl-lysine,AcK)插入到EGFP 特定位点的效率,从中筛选出插入效率高且正交的GCE体系 --- PLRS/4xtRNALeu对(图2a)。同时研究人员发现PLRS/4xtRNALeu对巴豆酰赖氨酸(Crotonyl-lysine,CroK)以及AcK类似物KetoTK具有较好的兼容性(图2b)。
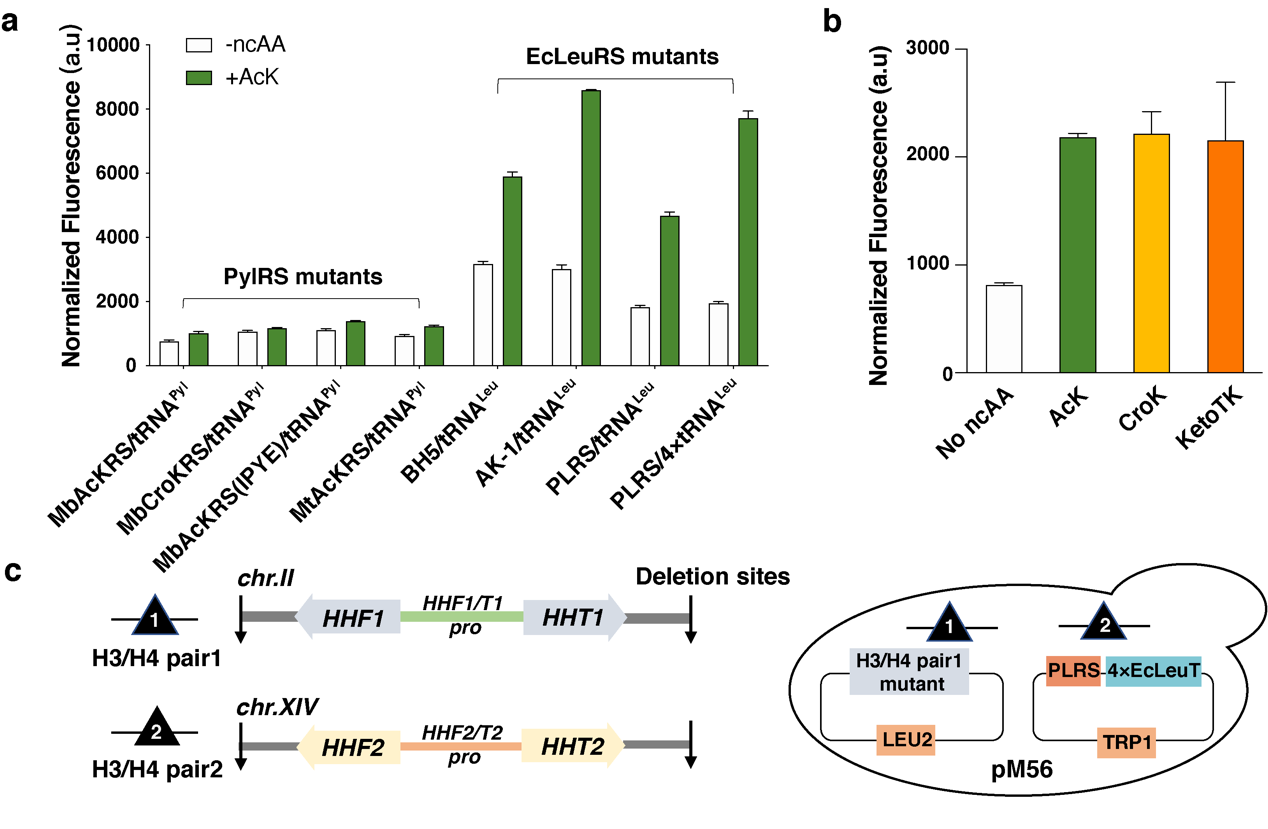
图2:酿酒酵母基因密码子扩展体系的筛选及含CTM核小体的酵母菌株(即pM56菌株)示意图
在CTM菌株中,基因组编码的野生型组蛋白H3被CTM组蛋白H3突变体所取代。组蛋白H3突变体可借助酿酒酵母基因密码子扩展体系对其56位点进行ncAA突变获得。这一菌株被命名为pM56菌株(图2c),该菌株呈现出ncAAs依赖生长的特性,即在含有一定浓度ncAAs的培养基中,pM56菌株才能存活。研究人员针对不同pM56菌株中组蛋白H3K56位点酰化修饰水平进行定量蛋白组学研究,结果表明,pM56AcK菌株中组蛋白H3K56位点的乙酰化修饰水平(~12%)低于野生型酵母菌株(~23%),pM56CroK菌株中组蛋白H3K56位点除存在~14%的巴豆酰化修饰以外,还存在~10%的乙酰化修饰,这说明pM56菌株中存在动态的修饰调控过程。为了研究组蛋白H3K56位点发生乙酰化共修饰或巴豆酰化共修饰之后,二者的生物学功能存在哪些差异,研究人员首先做了pM56菌株DNA损伤耐受实验,比较pM56AcK和pM56CroK菌株对甲磺酸甲酯(methyl methanesulfonate, MMS)的耐受差异,结果显示,pM56AcK对MMS的耐受程度高于pM56CroK菌株(图3a)。RNA测序结果显示,相比于MMS处理的pM56CroK菌株,pM56AcK菌株中水解酶表达水平显著性上调,酵母生殖和细胞壁相关的基因也出现了上调表达的情况,而pM56CroK菌株中激酶相关基因表达水平上调(图3b)。
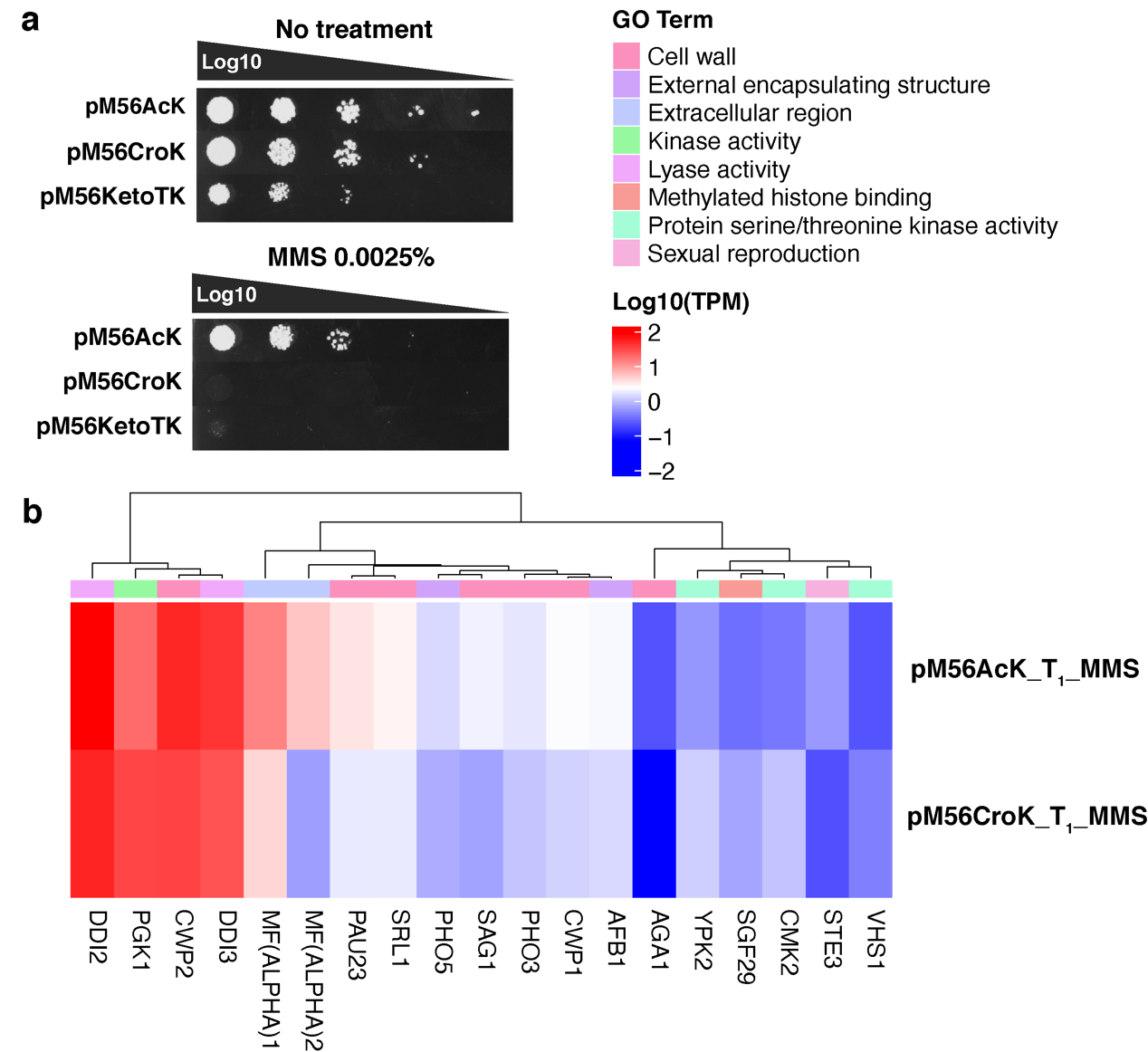
图3:pM56AcK和pM56CroK菌株产生不同的DNA损伤应答反应
本研究通过跨学科交叉合作,基于酿酒酵母的基因密码子扩展体系,探索性地将定点共翻译修饰作为合成表观遗传学的研究手段,创造了另一种可能的生命形式,即通过人为引入共翻译修饰的方式维持酵母生命活动的生命形式。这一特殊的生命体不仅为探索真核生物组蛋白翻译后修饰错综复杂的生物学功能提供了更多的可能性,同时也为研究在漫长的进化过程中翻译后修饰的角色演变提供了新的思路和视角。
本文的共同第一作者为北京大学药学院硕士生吴丹、博士后陈晓旭(现NWPU 博士后)、中国科学院深圳先进技术研究院合成生物学研究所助理研究员张云丰、北京大学基础医学院博士生唐志恒。通讯作者为北京大学药学院刘涛研究员、中国科学院深圳先进技术研究院合成生物学研究所研究员罗小舟、北京大学基础医学院刘小云研究员。该研究获得到国家自然科学基金项目、深圳合成生物学创新研究院对外开放基金项目、国家重点研发计划项目以及北京市自然科学基金项目的资助支持。
刘涛课题组长期致力于借助基因密码子扩展技术开展PTM功能研究和新型生物疗法开发的研究工作;罗小舟课题组一直致力于基于大数据及机器学习的蛋白质定向进化研究;刘小云课题组致力于高通量蛋白质组学方法的发展研究。
附件下载:


