器官移植已成为多种终末期疾病的唯一有效治疗手段,供体器官严重缺乏却限制了这一疗法在临床上广泛应用。据不完全统计,我国每年开展器官移植手术的患者2万多例,而因终末期器官功能衰竭等待移植的患者高达30万,供需缺口巨大。基于干细胞的器官异种动物体内再生将是未来解决这一问题的理想途径。通过该途径获得的人源化器官不仅将具有更全面的细胞类型和更完善的器官结构与功能,而且由于供体细胞来源于患者自体,将有效避免异种器官或同种异体器官移植中存在的免疫排斥等问题。
9月7日,中国科学院广州生物医药与健康研究院在国际权威学术期刊Cell Stem Cell(《细胞干细胞》)发表封面研究论文,报道了利用胚胎补偿技术在猪体内成功再造人源中肾的策略。
在研究中,研究人员利用具有高分化潜能、强竞争及抗凋亡能力的新型人诱导多能干细胞,结合优化的胚胎补偿技术体系,在肾脏缺陷猪模型体内实现了人源化中肾的异种体内再生,这是世界范围内首次报道的人源化器官异种体内再生案例。
基于胚胎补偿技术实现人源化器官异种体内再生存在诸多障碍,包括人源多能干细胞的分化能力不足,在异种动物胚胎内的生存能力低下、大动物模型提供的器官缺陷生态位难以形成、异种胚胎嵌合补偿技术体系不完善等,导致从猪体内培育人体器官的设想一直没有成功。
为了寻求突破点,中国科学院广州生物医药与健康研究院赖良学课题组、潘光锦课题组以及Miguel A. Esteban课题组组成联合攻关团队,在中国科学院“器官重建与制造”战略性先导科技专项的支持下,围绕人体肾脏的异种再生这一世界难题开展了5年多的探索。
攻关团队对人-猪胚胎补偿技术体系进行了全方位的优化,最终确定了理想的胚胎补偿技术流程,即在桑葚到早期囊胚时期注射3-5个人源供体细胞,以构建嵌合胚胎,后者在等比例混合的胚胎培养基和干细胞培养基中培养24小时后,移植入发情周期同步的代孕猪,即可获得嵌合猪胎儿,最终成功实现了人源化中肾的异种体内再生。
该研究严格遵守相关伦理规定以及国际惯例,在3-4周胎龄内终止了妊娠。共获得2只胎龄25天,3只胎龄28天的中肾嵌合胎儿。这些嵌合胎儿的中肾内人源细胞占比最高可达70%,而人源细胞参与形成的中肾小管所占比例最高可达58%。针对肾脏发育关键功能性基因SIX1,SALL1,PAX2及WT1的免疫荧光染色结果证明,人源供体细胞已分化成为表达这些基因的功能性细胞,说明伴随着胚胎发育,肾脏缺陷猪胎儿体内的人源供体细胞将能够支持人源化肾脏生成。
这项成果首次证明了基于干细胞及胚胎补偿技术在异种大动物体内再造人源化实质器官的可行性,为利用器官缺陷大动物模型进行器官异种体内再生迈出了关键的一步,对解决供体器官严重短缺难题具有重要意义。
中国科学院广州生物医药与健康研究院博士后王教伟、谢文广,副研究员栗楠、李文娟以及博士研究生张智帅为该论文的共同第一作者。中国科学院广州生物医药与健康研究院赖良学研究员、戴祯研究员、Miguel A. Esteban研究员以及潘光锦研究员为本论文的共同通讯作者。项目受到中国科学院战略性先导科技专项、国家重点研发计划等基金的资助。
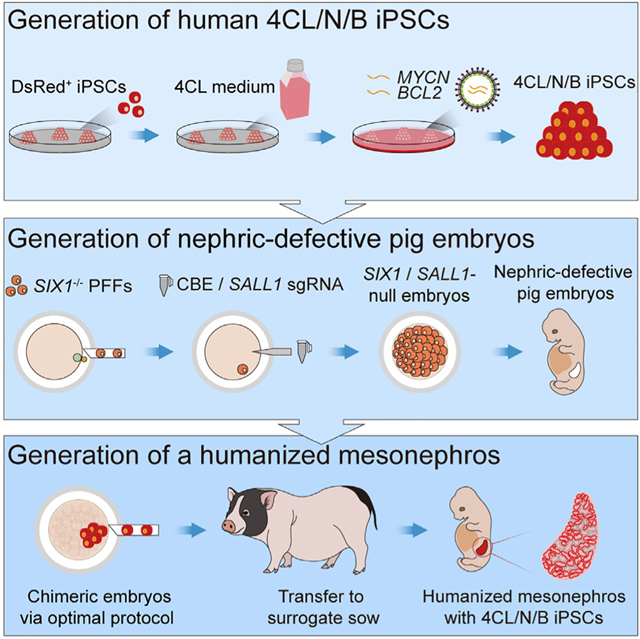
本研究示意图

附件下载:


