北京时间1月12日晚,深圳理工大学(筹)药学院教授、中国科学院深圳先进技术研究院医药所癌症免疫研究中心赵佳伟联合哈佛大学医学院附属波士顿儿童医院教授Vijay Sankaran团队通过群体遗传学的方法,发现了髓系恶性血液肿瘤易感性的重要家族风险因素,并揭示了转录延伸在其中的重要作用机制,相关成果发表在《细胞》杂志上。
血液肿瘤是一类常见的恶性肿瘤,与其他实体恶性肿瘤不同,髓系血液恶性肿瘤几乎常见于各个年龄段,具有明显的可遗传性。尽管近几十年对血液恶性肿瘤发生的体细胞驱动突变(Somatic Driver Mutation)的发现和相关致病机理已经有了较完整的研究,我们对可遗传的胚系突变(Germline Mutation)在血液肿瘤发生中的作用理解仍非常有限。
作为群体遗传学的重要研究手段,全基因组相关联研究(Genome Wide Association Study, GWAS)在识别和寻找可遗传性胚系突变的致病作用中具有不可忽视的意义。例如,胎儿向成人血红蛋白素表达转换的重要调控因子BCL11A的发现就要归功于全基因组相关联研究技术。然而,全基因组相关联研究技术在某些方面上却具有天然的劣势。这种劣势主要表现在GWAS技术高度依赖于基因组测序技术以及大量样本,然而过去的几十年内全基因组测序的高额费用使得GWAS技术仅仅只能应用于以微阵列技术为主体的发生频率超过5%的常见突变体。从孟德尔经典遗传学以及宏观进化中可知,有害突变体的发生频率通常非常低,而常见突变体的外显率(Penetrance)通常比较低,因此通过GWAS的方法找到的常见突变体对恶性肿瘤形成的实际意义在遗传学和癌症生物学中一直存在争议。
然而,随着全基因组测序技术日趋成熟,测序的费用也有了显著的下降,越来越多的全基因组测序数据的释放使得群体遗传学进入了一个新纪元,即我们可以通过全基因组测序找到的罕见突变体来进行罕见突变体相关联研究(Rare Variant Association Study, RVAS)。通过RVAS找到的髓系恶性血液肿瘤易感性的重要家族风险因素(CTR9突变体)相比传统GWAS找到的风险因素致病可能性具有显著的提高(1000% v.s. 25%)。
CTR9是PAF1蛋白质复合体的重要支架蛋白,在结构上具有粘合PAF1蛋白质复合体其余亚基CDC73,PAF1,LEO1,WDR61的重要作用,而PAF1复合体通常被认为在RNA聚合酶进行转录延展时具有重大作用。在后续的研究中,赵佳伟发现当且仅当CTR9部分缺失时,人长期和短期造血干细胞具有显著性的扩增,且扩增的造血干细胞是具备干细胞功能的。从机制上,当CTR9部分缺失时,一部分PAF1复合体亚基将完全解离成为游离的蛋白质,在这部分游离的蛋白质中,CDC73和PAF1可以通过MLLT3加入另一个蛋白质复合体,超级延展复合体(Super Elongation Complex, SEC)。加入了CDC73和PAF1的SEC可以特异性地提升与造血干细胞自我更新相关的转录因子即其他相关蛋白质的mRNA延展效率,从而提高造血干细胞的扩增。
该研究展现了群体遗传学,特别是全基因组相关联研究在复杂疾病致病机理中的巨大作用,为家族性髓系恶性血液肿瘤发生的机理提供了新思路。同时,此项研究揭示了以往尚未被解释的PAF1复合体亚基与SEC的潜在关联性。鉴于SEC在多种血液肿瘤发生中具有不可或缺的作用,以PAF1复合体亚基与SEC结合的蛋白为靶点可能会成为某些类型的髓系白血病药物发展的新思路。
赵佳伟教授、Liam Cato博士为本文共同第一作者,赵佳伟教授、Vijay Sankaran教授为本文共同通讯作者。
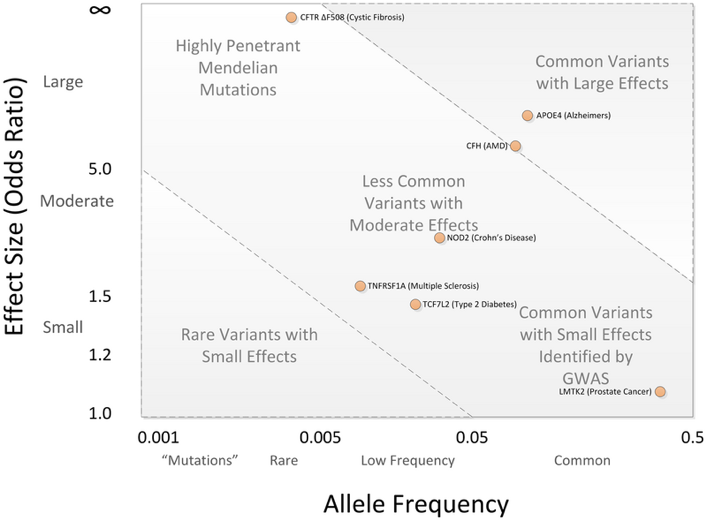
图1 突变体/单碱基多样性随着发生频率的下降造成更高的外显率。当等位基因频率小于0.005且概率比例(odds ratio)大于5时,该突变体基本遵循孟德尔遗传,而常见单碱基多样性(发生频率大于0.05)通常难以产生较大的概率比例,只有在捕捉到罕见单碱基多样性时该等位基因才可能会对目标性状具有有较大影响。
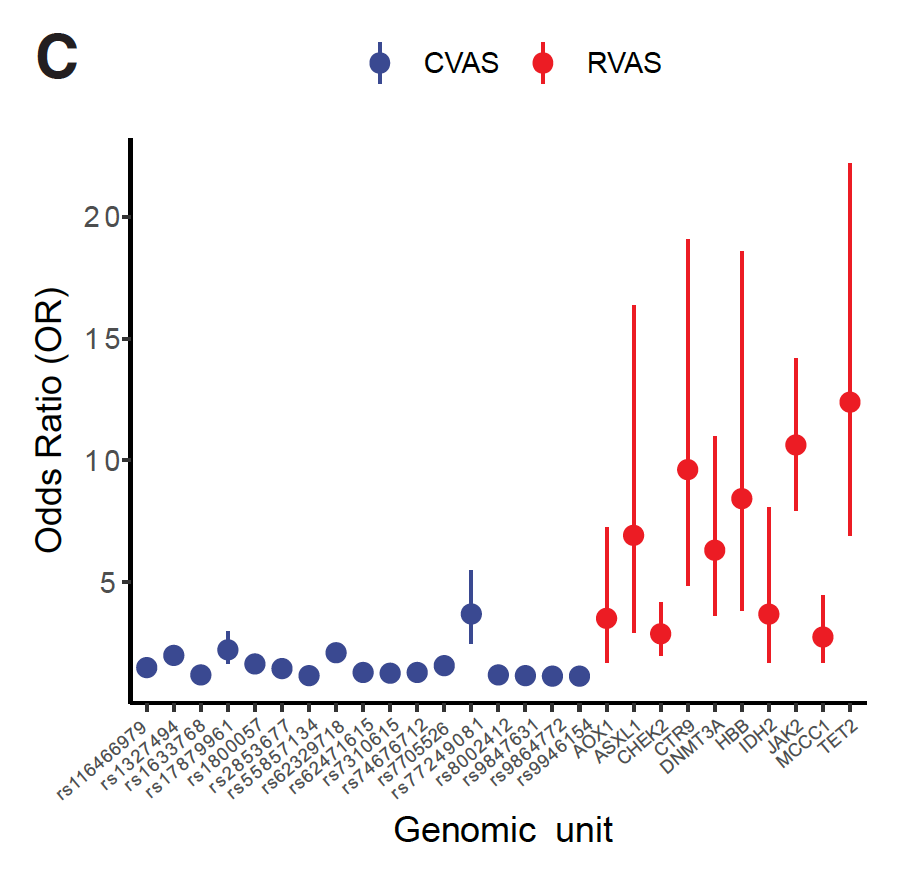
图2 相对于常见单碱基多样性的GWAS(CVAS),罕见单碱基多样性(RVAS)的概率比例显著提高,其造成的外显率比例也显著上升
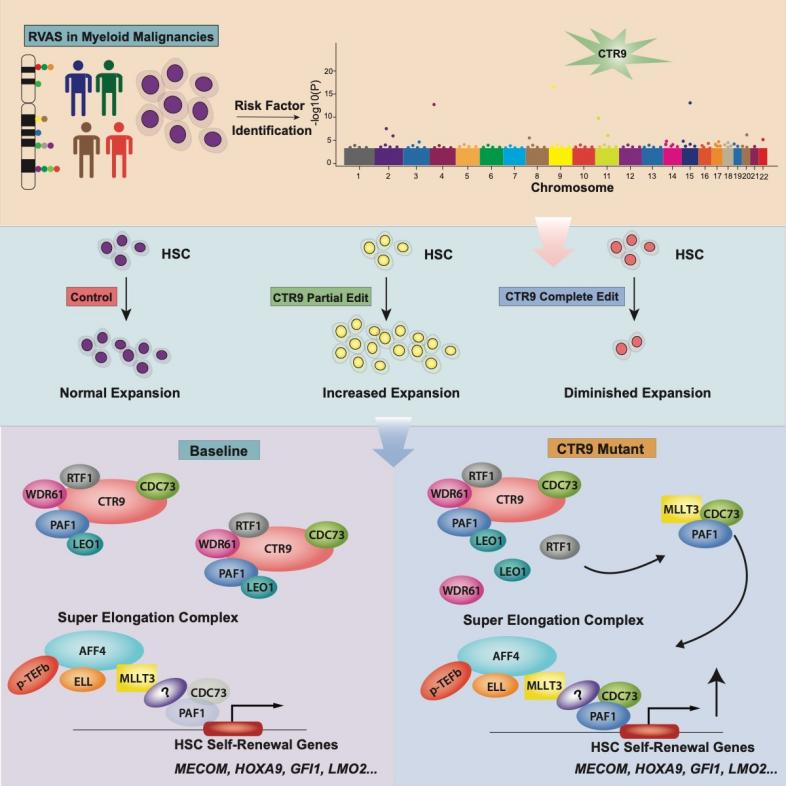
图3 部分CTR9的缺失使得一部分PAF1复合体被拆解,释放出的部分亚基,如PAF1和CDC73被超级延展复合体募集,从而增强与造血干细胞稳态与自我更新有关的基因如MECOM, GFI1B, LMO2等的转录延展,从而调高这部分基因的表达,导致造血干细胞扩增的后果。而CTR9/PAF1复合体作为一类管家基因对于细胞的存活是不可或缺的,因此CTR9完全缺失的造血干细胞无法长期维持稳态。
附件下载:


