近日,中国科学院广州生物医药与健康研究院潘光锦课题组在Nucleic Acids Research期刊发表了题为“HBO1 determines SMAD action in pluripotency and mesendoderm specification”的文章。该研究揭示了乙酰转移酶HBO1在人胚胎干细胞多能性维持及中内胚层谱系特化中的作用及分子机制。
HBO1属于MYST乙酰转移酶家族,通过介导组蛋白乙酰化修饰,在胚胎发育、细胞命运及肿瘤发生中发挥关键作用。前期研究发现MYST-HBO1乙酰转移酶复合物的骨架蛋白BRPF1在人胚胎干细胞多能性的维持过程中发挥重要作用(Zhang C., et al., iScience, 2023)。但是该复合物中具有乙酰转移酶活性的亚基-HBO1在人胚胎干细胞命运决定中的作用尚不清楚。
该研究发现缺失乙酰转移酶HBO1的人胚胎干细胞丧失多能性,并自发分化为神经外胚层细胞。通过高浓度的BMP4诱导早期原肠胚形成和畸胎瘤实验发现缺失HBO1的人胚胎干细胞其中、内胚层分化能力存在缺陷,表明HBO1对于中、内胚层的形成很重要。HBO1含有多个结构域,为了验证这些结构域的功能,研究者设计多种HBO1截短突变体进行回补实验,发现HBO1的乙酰转移酶活性对于多能性的维持是必须的。为了研究HBO1主要调控何种乙酰化修饰,研究者在野生型和缺失HBO1的人胚胎干细胞中进行了免疫印迹和CUT&Tag-seq实验,发现乙酰转移酶HBO1介导H3K14ac共同定位在多能性相关基因的启动子上。通过之前的CUT&Tag-seq实验,研究者发现发现HBO1富集的motif中包含SMAD motif,通过Co-IP实验也验证HBO1和SMAD4存在相互作用。SMAD4是TGF 信号传导入核的关键蛋白,TGF 信号通路在干细胞多能性维持和早期胚胎谱系分化过程中发挥重要作用,然而TGF 信号通路是如何介导靶基因表达的还有待研究。
该研究发现,在TGF 存在的情况下,乙酰转移酶HBO1的缺失导致TGF 信号通路下游靶基因的表达显著性降低。表明HBO1对于TGF 信号通路下游靶基因的表达是必需的。为了研究HBO1与SMAD4相互依赖性,研究者在野生型和缺失HBO1的人胚胎干细胞中进行了CUT&Tag-seq实验,发现HBO1的缺失,不影响SMAD4与染色质的结合。但是通过TGF 信号通路抑制剂(SB431542/Dorsomorphin, 2I)处理一天,导致HBO1与染色质的结合明显减少。表明SMAD4对于HBO1与染色质的结合至关重要。为了进一步明确HBO1在胚层分化中的作用机制,研究者通过定向诱导人胚胎干细胞分化为神经干细胞(外胚层)和原条(中胚层)细胞,结合CUT&Tag-seq实验,发现在神经干细胞中SMAD4和HBO1与染色质的结合基本上检测不到,在中胚层细胞中SMAD4与HBO1高度富集在与中胚层谱系发育相关基因的启动子区。表明在多能性退出过程中SMAD4-HBO1共同定位在中胚层谱系相关基因上。
综上,该研究揭示了乙酰转移酶HBO1在人胚胎干细胞命运决定中的作用及机制,拓展并丰富染色质重塑因子调控细胞命运转变的生物学功能,为优化高效获得神经谱系细胞的技术体系提供了新的思路。
中国科学院广州生物医药与健康研究院博士后张聪为该论文的第一作者,中国科学院广州生物医药与健康研究院潘光锦研究员为该论文的通讯作者。该研究成果得到了国家重点研发计划、国家自然科学基金、广东省科技计划项目、广州市重点研发计划等项目的资助。
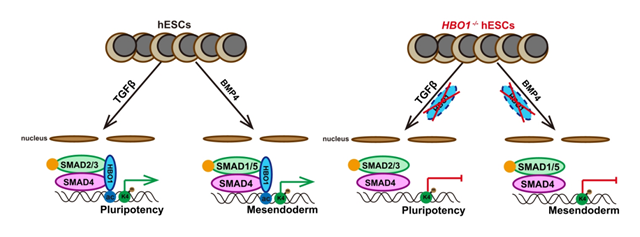
乙酰转移酶HBO1通过SMAD4决定多能性和中内胚层谱系分化示意图
附件下载:


