哺乳动物骨髓由多种类型的细胞组成,包括脂肪细胞、成骨细胞、破骨细胞、基质细胞和血管内皮细胞。这些细胞之间的相互作用为骨髓干细胞(也称为基质或间充质干细胞,BMSCs)和其他谱系细胞的分化提供了关键的调节环境。成骨细胞和骨髓脂肪细胞(bone marrow adipocytes,BMAds)虽然功能和形态上不同,但都起源于同一前体细胞——BMSCs。骨髓脂肪组织(MAT)是骨髓的重要组成部分,具有能量储存和内分泌调节功能,对于维持骨稳态至关重要。然而,骨髓脂肪细胞的过度积累与骨质恶化有关,通常被认为不利于骨髓微环境的稳态。
近日,中国科学院深圳先进技术研究院管敏研究员课题组(课题组博士后黄童龄为本文的第一作者)在Nature Communications发表了题为“Targeting adipocyte ESRRA promotes osteogenesis and vascular formation in adipocyte-rich bone marrow ”的研究论文,脂肪细胞中的雌激素相关受体α(estrogen-related receptor α,ESRRA)通过正调控leptin和反向调节分泌型磷蛋白 1(secreted phosphoprotein 1,Spp1)的表达和分泌,从而影响骨髓中富含脂肪细胞的骨生成和血管形成。同时,探讨ESRRA作为治疗骨质疏松的潜在靶点的可能性。

文章上线截图
有研究表明,高脂肪饮食(HFD)诱导肥胖小鼠通过循环瘦素(leptin)作用于表达瘦素受体(LepR+)的BMSCs,促进脂肪形成,抑制BMSCs成骨,从而加速MAT的扩张。因此,病理条件导致骨微环境中异常信号的存在,驱动BMSCs分化命运转变,即成脂分化增强而成骨分化减少,从而导致骨量减少、骨微结构破坏和MAT堆积。事实上,在多种临床病理情况下,如肥胖、糖尿病、神经性厌食症、糖皮质激素治疗、放疗、更年期和衰老,骨量减少常伴随着MAT的异常扩增。然而,这些异常扩增的BMAds如何介导骨髓驻留细胞行为的确切机制仍然难以确定。
BMAds位于骨髓微环境中,与血管和造血系统密切接触。2014年Ralf Adams教授课题组在Nature上发表“背靠背”研究论文,证实骨组织中存在一种特异性血管亚型——H型(CD31hiEMCNhi)血管,它们与骨祖细胞关联,支持骨形成,H型血管异常与衰老和绝经后的骨质疏松症发生发展相关。BMAds可分泌多种分泌因子,包括leptin、脂联素(adiponectin)和干细胞因子(SCF)等,从而参与骨髓微环境中骨生成、血管形成和造血功能的稳态维护。因此,BMSCs分化命运的改变(成骨减少、成脂增加)和血管形成障碍是导致骨质疏松症的重要影响因素。然而,这些同时发生的具体调控机制仍有待深入阐明。
在本研究中,研究人员发现在高脂饮食介导肥胖和卵巢切除介导雌激素缺乏的病理条件下,小鼠主要表现为骨量减少伴随骨髓脂肪细胞数量增加;同时,骨骺端生长板下H型血管密度降低且血管结构和形态异常,以及周围成骨前体细胞数量明显减少。以转录因子ESRRA为研究对象,利用Adiponectin-Cre工具鼠构建了成熟脂肪细胞特异性ESRRA敲除小鼠模型。
通过系统的骨形态计量学和组织学分析,发现条件性敲除脂肪细胞Esrra基因能够明显增加骨微环境中骨祖细胞数量,促进骨形成,并且增强骨髓H型血管形成,从而明显改善骨质丢失。进一步机制研究发现,骨髓脂肪细胞中ESRRA直接与leptin基因启动子上的ESRRA反应元件(ERRE)结合,增强其转录表达和分泌。此外,ESRRA干扰E2/ESR1驱动的Spp1启动子激活,从而下调SPP1的表达和分泌。条件性敲除ESRRA后,通过抑制脂肪细胞leptin的表达和分泌,增强骨髓LepR+BMSCs的成骨分化,进而抑制BMAds的扩增。同时,BMAds或白色脂肪细胞分泌的SPP1可锚定骨髓,发挥促血管内皮细胞迁移和血管新生的作用,同时增加骨祖细胞在骨骺端 H 型血管周围的聚集和分化,最终促进骨形成。
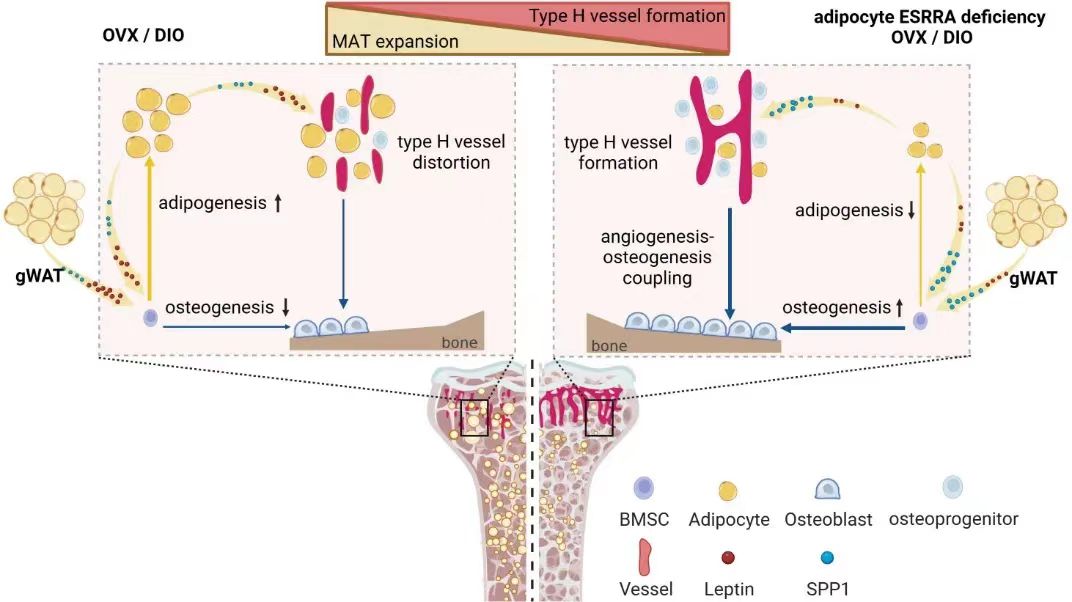
脂肪细胞ESRRA调控leptin和SPP1表达及分泌影响骨质疏松病理性微环境的骨髓脂肪扩张和成骨成血管作用
研究结果表明了脂肪细胞ESRRA可通过调控BMSCs成骨成脂分化方向以及H型血管的形成,改善肥胖/雌激素缺乏所导致的骨丢失。因此,进一步建立高脂诱导肥胖和骨丢失小鼠模型,并喂食ESRRA特异性拮抗剂Compound 29。实验结果显示,经治疗后的小鼠骨形成能力显著增强,骨髓脂肪细胞显著减少,有效抵抗肥胖小鼠的骨丢失和BMAds异常扩增。综上所述,该研究揭示了病理性骨微环境中,脂肪细胞ESRRA调控分泌因子影响BMSCs成骨成脂分化命运及血管内皮细胞的血管生成,提示骨髓脂肪细胞ESRRA是潜在的药物靶点,为治疗骨质疏松症等骨疾病提供了新途径。
附件下载:


