近日,中国科学院广州生物医药与健康研究院(以下简称“广州健康院”)与广州医科大学附属第一医院、广州国家实验室等单位合作在Cell Reports发表题为An unconventional VH1-2 antibody tolerates escape mutations and shows an antigenic hotspot on SARS-CoV-2 spike的研究论文。
面对自然感染和疫苗接种产生的免疫压力,新冠病毒持续进化和变异,逃逸了绝大部分早期筛选获得的中和抗体。其中,在人群中被广泛诱导的VH1-2基因编码抗体被认为在新冠病毒早期的抗体免疫中起到了关键作用,但由于新冠病毒刺突蛋白E484K/A的突变,大多数VH1-2类抗体被逃逸。在该研究中,研究人员从早期新冠病毒野生株感染者中筛选到一株由VH1-2基因编码的中和抗体D1F6。不同于其他已知的VH1-2抗体,D1F6不被携带E484A突变的Omicron变异株逃逸,对Omicron变异株的多种亚型仍保持高效中和活性。动物实验结果表明D1F6可以有效抑制Delta和Omicron BA.5、XBB.1.5、EG.5.1等变异株在小鼠体内的复制。
研究团队利用冷冻电镜、抗体抗原相互作用和病毒中和实验对D1F6的中和机制及其耐受突变的分子机制进行了探究。研究结果显示,D1F6结合刺突蛋白不受其构象的影响,能够同时结合“向上”和“向下”的受体结合域(RBD),且抗体的结合可以阻断ACE2受体的结合,因此D1F6通过阻断病毒与受体的结合发挥中和作用。另外,研究发现,虽然D1F6结合RBD会受一些热点突变的影响,但是由于多重结合效应(avidity),D1F6仍能高效结合相应突变的刺突蛋白,从而耐受这些突变的影响。
相比传统的VH1-2新冠病毒中和抗体,D1F6经历了抗体的亲和成熟过程,重链中存在大量体细胞超突变引入的氨基酸,这使其结合位置相较于经典的VH1-2类抗体有约30 Å的偏移,因此不易受E484K/A突变的影响。通过系列的表位突变研究,研究人员发现D1F6表位内的单点或双突变对其中和效果的影响很有限,需多个氨基酸(至少3个)同时突变才能影响D1F6的活性。
研究最后对刺突蛋白进行了序列分析,发现D1F6结合表位及周围区域是新冠病毒刺突蛋白RBD中氨基酸突变的热点区域。研究人员提出,由于D1F6为代表的II类抗体结合刺突蛋白不受其构象的影响,且II类抗体能通过阻断病毒结合受体发挥中和作用,因此对新冠病毒具有较强的免疫压力。面对D1F6这种具有较强耐受突变能力的亲和成熟抗体,新冠病毒需不断积累突变进行免疫逃逸。
综上,研究揭示了非典型VH1-2抗体D1F6抗体通过多重结合效应和亲和成熟作用耐受刺突蛋白突变的分子机制,并提示新冠病毒在免疫压力选择下会通过不断积累抗原突变来逃逸亲和成熟抗体。
广州健康院熊晓犁研究员、广州国家实验室陈凌研究员、广州医科大学赵金存教授和牛学锋副研究员为本论文的共同通讯作者。广州健康院助理研究员刘邦慧、广州医科大学副研究员牛学锋、硕士研究生邓奕君和博士研究生张昭勇为本论文共同第一作者。该研究得到了国家自然科学基金、广东省自然科学基金、广州实验室应急攻关项目等的资助。
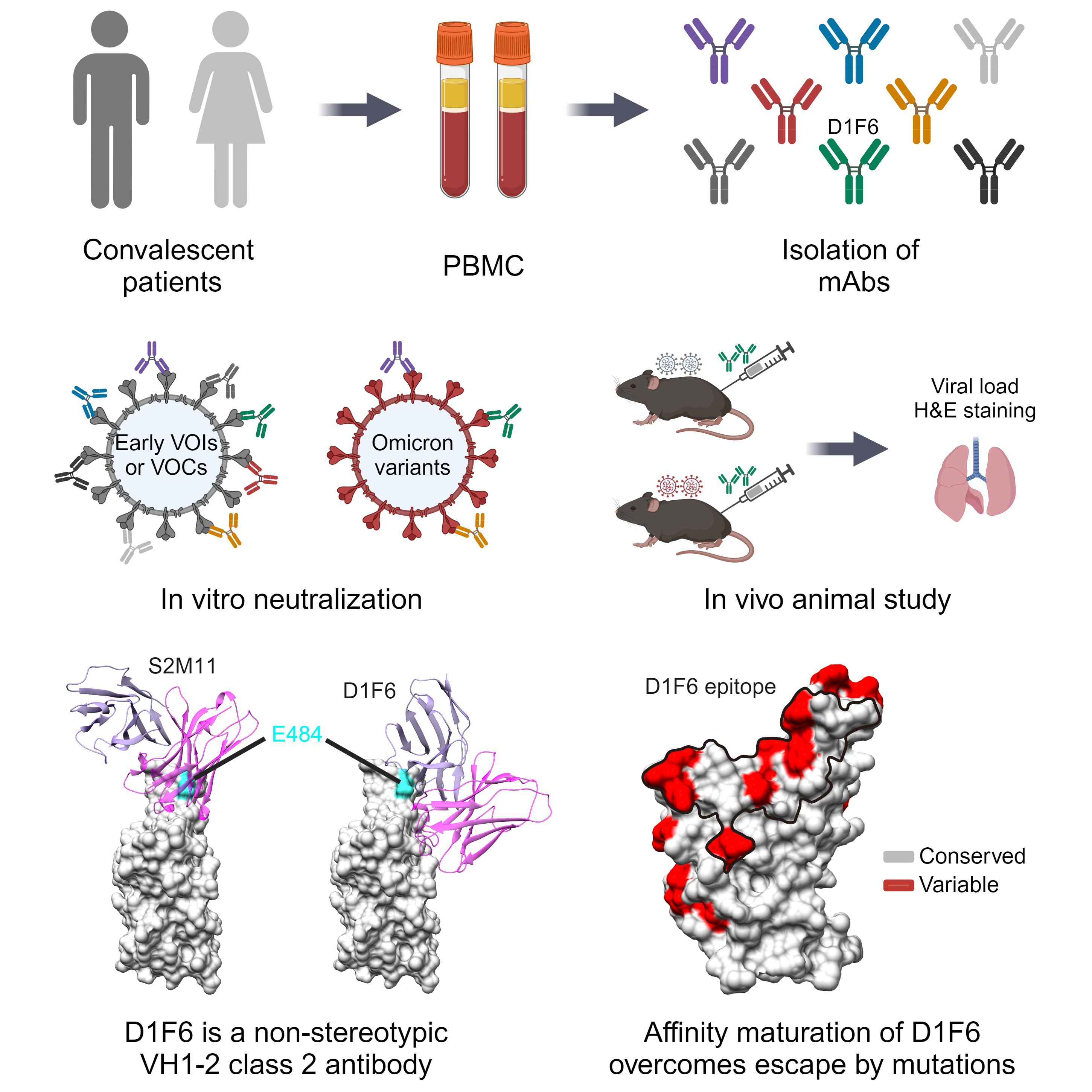
图1 中和抗体D1F6的筛选、功能测定及结构分析
附件下载:


