靶向蛋白质降解技术在生物医学领域具有巨大潜力,尤其是在治疗肿瘤和其他蛋白质相关疾病方面。利用分子胶和PROTAC技术降解细胞内蛋白的研究处于领先地位,而通过溶酶体途径降解膜蛋白和胞外蛋白及其它大分子的研究仍处于临床前阶段。可利用靶点的匮乏极大地限制了技术的进步,因此探索新的、潜在有效的溶酶体靶向降解策略至关重要。
6月20日,中国科学院深圳先进技术研究院医药所耿晋团队在Journal of the American Chemical Society上发表了题为“Lysosome Targeting Chimaeras for Glut1-Facilitated Targeted Protein Degradation”的研究成果。这项工作创新性地利用葡萄糖转运蛋白Glut1作为溶酶体靶向受体,设计了Glut1促进溶酶体降解(GFLD)策略。通过可逆加成-断裂链转移(RAFT)聚合制备了潜在的Glut1配体,并通过生物正交反应合成了抗体-糖寡聚物共轭物,将其作为溶酶体靶向蛋白降解分子,用于治疗PD-L1高表达的三阴性乳腺癌。本研究证明了葡萄糖转运体Glut1作为一种溶酶体靶向受体,在生物医学领域有着更广泛应用的潜力。
文章上线截图
鉴于糖转运蛋白对采用吡喃糖环椅构型的戊糖和己糖的D-立体异构体(如D-葡萄糖、D-半乳糖)具有很强的特异性,研究团队选择以D-葡萄糖和D-半乳糖为基础制备了带丙烯酰胺的糖单体,并进一步通过可逆加成断裂链转移(RAFT)聚合制备了五种含糖寡聚物。五种寡聚物随后被作为候选的葡萄糖转运蛋白Glut1配体进行了体外实验,包括用Glut1蛋白和五种糖链进行分子对接与计算模拟、结合亲和力测试,并通过细胞实验筛选出细胞摄取量高的配体来合成溶酶体靶向嵌合体分子。
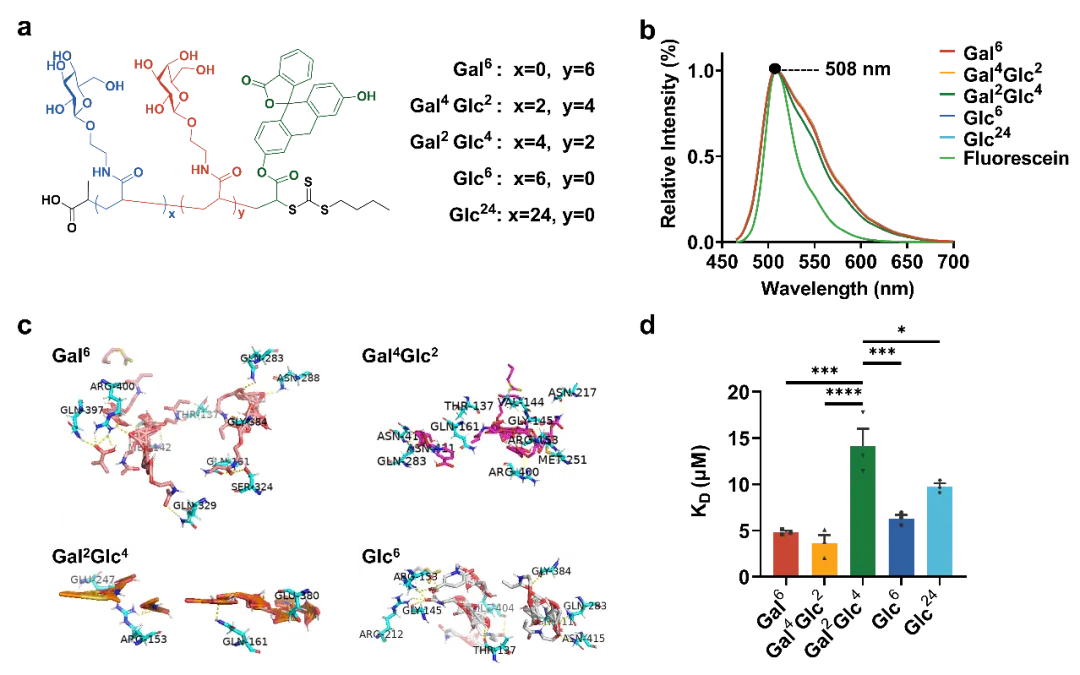
图1. 有潜力的Glut1配体的表征
由于人源三阴性型乳腺癌细胞系MDA-MB-231和MCF-7具有Glut1高表达的特点,因此本研究以之为细胞模型开展体外实验。体外筛选分为三个部分,先通过细胞流式实验比较细胞对五种候选配体的摄取情况,结果表明Gal6,Gal4Glc2和Glc6这三种糖寡聚物的内化程度较高,通过激光扫描共聚焦显微镜观察上述三种配体与溶酶体的共定位情况,发现摄取量高的三种糖寡聚物内化进入细胞后与溶酶体的共定位程度也较高。
鉴于这一结果推测这三种糖寡聚物的内化途径与溶酶体相关,因此团队进一步通过细胞流式实验探究配体的摄取途径,证明了糖寡聚物在细胞中的摄取是通过溶酶体途径且与Glut1相关。综合上述细胞实验结果,研究团队筛选出了有潜力的Glut1配体Gal6,Gal4Glc2和Glc6进行下一步的溶酶体靶向嵌合体分子合成。
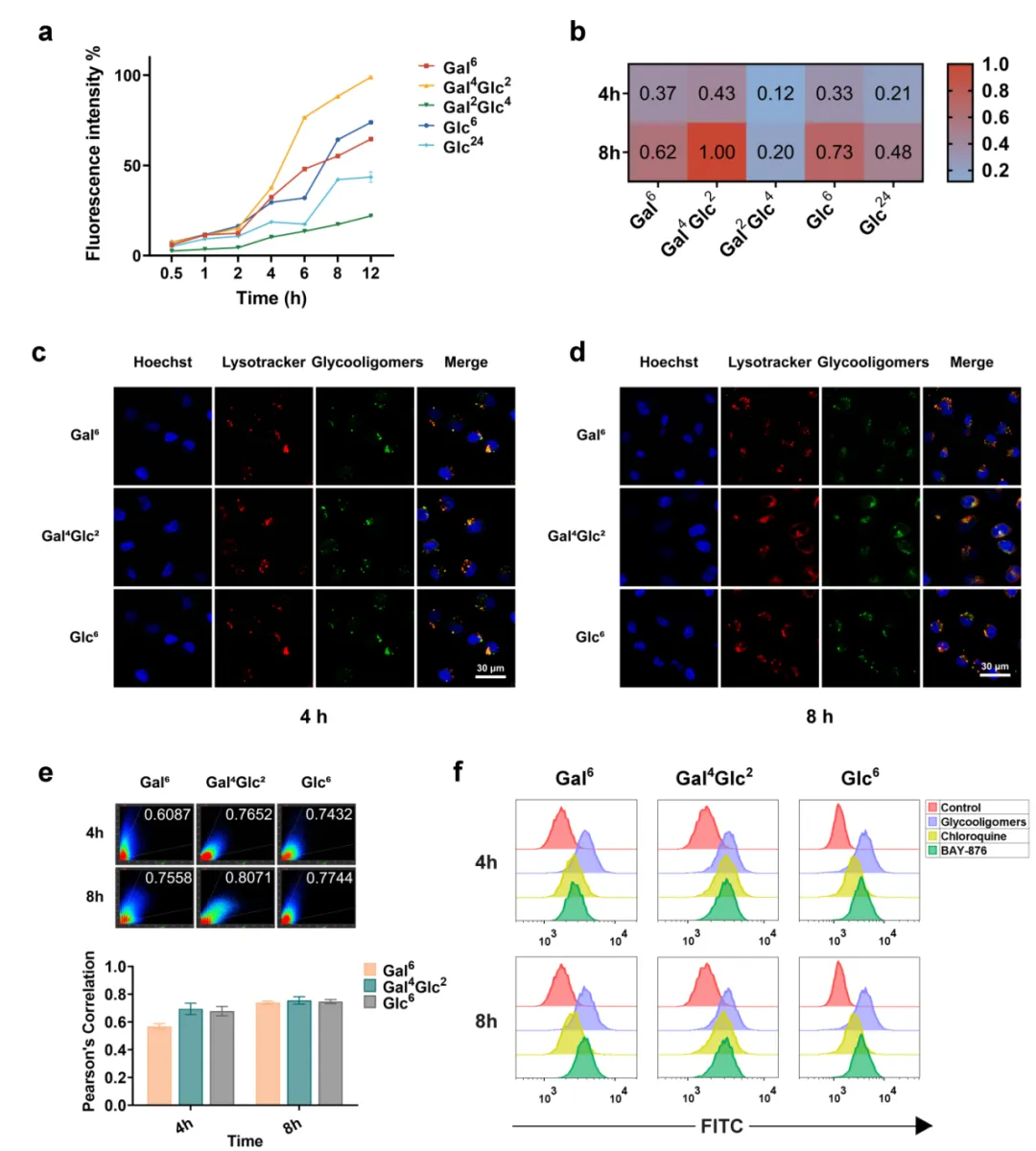
图2. 在MDA-MB-231细胞系中筛选Glut1配体
研究团队以MDA-MB-231细胞系高表达的免疫检查点PD-L1为目标蛋白,选取内化有限的PD-L1抗体Avelumab进行Ave-糖寡聚物共轭物分子的合成。通过三个经典的正交反应将筛选出的有潜力的Glut1配体Gal6、Gal4Glc2和Gal6分别连接到抗体Avelumab上,得到三种有潜力的溶酶体靶向嵌合体分子。通过CCK8检测法评估了三种Ave-糖寡聚物共轭物分子对MDA-MB-231细胞的毒性作用,确保细胞中PD-L1的减少并非由于Ave-糖缀合物分子的细胞毒性引起。随后通过免疫印迹法和免疫荧光检测验证了三种Ave-糖缀合物都是有潜力的能适度降解PD-L1的蛋白降解剂,其中Ave-Gal6的降解效果最佳。

图3. Ave-糖寡聚物共轭物的蛋白质降解活性具有浓度依赖性
此外,免疫印迹检测的结果显示PD-L1和Glut1的蛋白表达量随处理时间的延长具有一致的变化趋势,对此研究团队认为在逆转运复合体的作用下,Glut1有从溶酶体逃逸并返回细胞膜表面的行为,进而引发PD-L1-Ave-糖寡聚物-Glut1复合物也被带回到膜上,导致PD-L1蛋白的降解效果尚有提升空间。
团队进一步探讨了Ave-糖缀合物降解 PD-L1蛋白的降解机制是否与糖寡聚物内化进入细胞的途径相关,免疫印迹实验结果显示Ave-糖寡聚物共轭物分子降解PD-L1蛋白是通过溶酶体途径介导,并且揭示了Glut1在此策略中扮演了重要角色,相信葡萄糖转运蛋白Glut1将在未来的靶向蛋白降解技术中得到更广泛的应用。
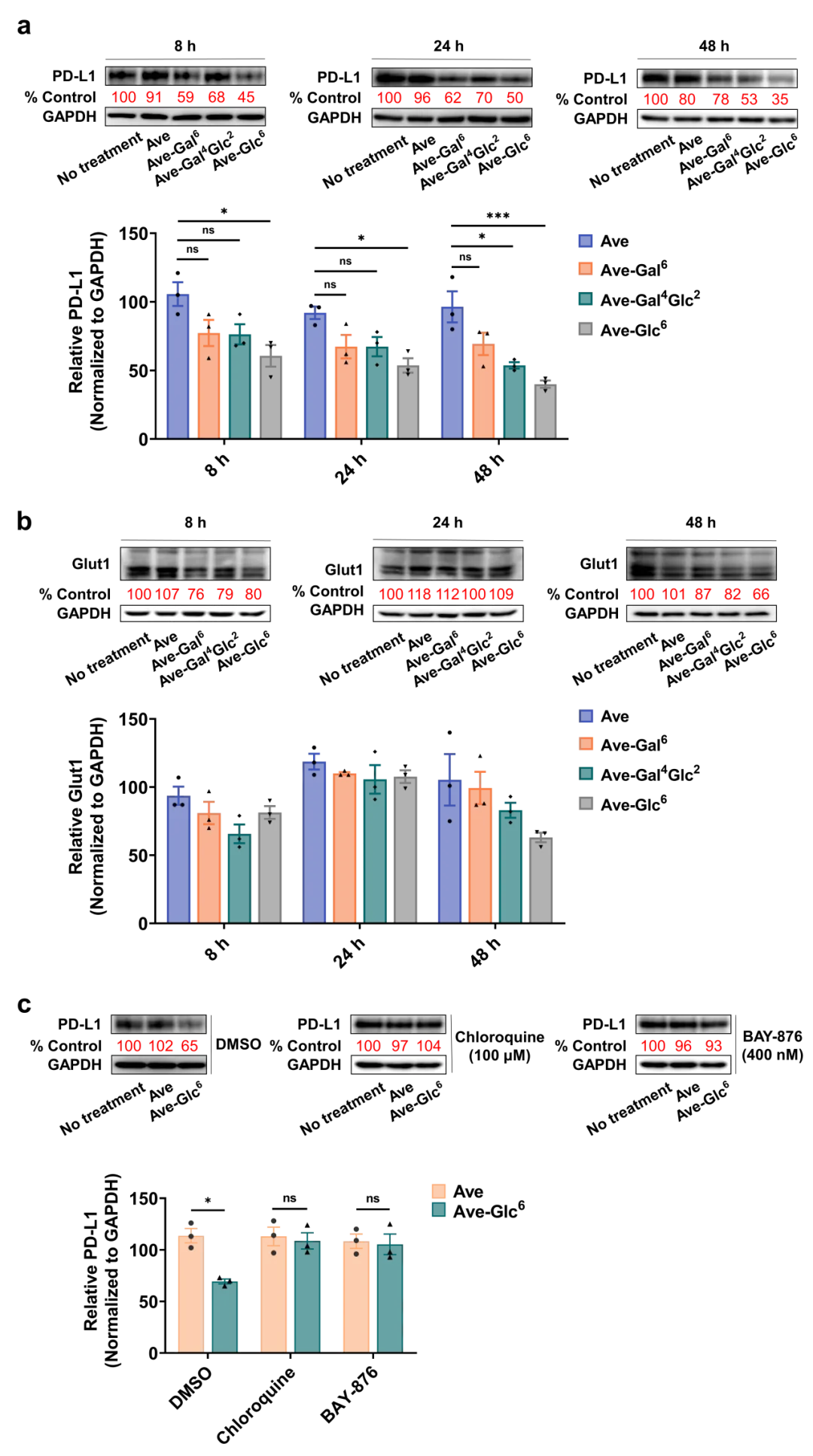
图4. Ave-糖寡聚物共轭物靶向蛋白降解效率随时间的变化情况及其降解机制
综上所述,本研究成功开发了基于溶酶体靶向嵌合体技术的蛋白质降解剂,为肿瘤治疗提供了新的治疗思路,并成功验证了葡萄糖转运蛋白Glut1是一种适用于蛋白质降解技术的溶酶体靶向受体,创新性地提出了Glut1促进溶酶体途径的蛋白降解(GFLD)策略,用于靶向降解膜蛋白,为蛋白质降解技术的发展铺平了道路。目前,很多蛋白结合力好但内化效果欠佳的抗体无法充分发挥价值,利用Glut1促进溶酶体途径的蛋白降解策略有望在不久的将来改善这些抗体的内化效果,预计这将大大推进抗体偶联药物的开发进程,拓展抗体在医学领域的应用场景,并提高临床转化率。
中国科学院深圳先进技术研究院耿晋研究员为本文的通讯作者,硕士研究生罗锦妍和高权博士为文章共同第一作者。该研究获得了国家自然科学基金、广东省自然科学基金、中国科学院国际合作项目的支持。
附件下载:


