真核生物的基因组DNA以复杂而有序的层级结构折叠于细胞核中,包括:远距离染色质环、拓扑相关结构域(TAD)、染色质区室和染色质疆域等。这些染色质高级结构的动态变化与细胞命运决定以及疾病的发生发展密切相关。CCCTC结合因子(简称CTCF)最初被报道作为绝缘子结合蛋白发挥作用。另外,CTCF作为染色质架构蛋白在调节染色质高级结构中同样发挥重要的功能。姚红杰课题组前期在CTCF的分子生物学功能研究方面取得了一系列进展,包括筛选CTCF的共定位因子、鉴定CTCF可变剪切体并解析其分子细胞功能、CTCF调控染色质绝缘和染色质开放协同调控体细胞重编程为诱导多能干细胞等。此外,临床研究发现CTCF基因突变与多种发育障碍疾病相关,如智力发育迟缓、自闭症谱系障碍和先天性心脏病等。CTCF精氨酸567突变为色氨酸(R567W)的临床表现为智力障碍、喂养困难,并伴随自闭症样等特征。然而,CTCF R567W突变导致这些复杂发育异常的分子机制仍不清楚。
2024年7月1日,姚红杰研究团队在Nature communications(《自然通讯》)期刊上发表了题为CTCF mutation at R567 causes developmental disorders via 3D genome rearrangement and abnormal neurodevelopment的研究论文。该研究综合运用小鼠模型和人源类器官模型,揭示了染色质架构蛋白CTCF的R567W点突变通过调控CTCF在染色质上的结合和局部三维基因组结构,进而导致神经发育障碍的分子机制。这一发现为理解CTCF突变导致临床发育疾病提供了重要见解。
研究团队首先在小鼠模型中引入CTCF-R567W点突变,以模拟其对发育的影响。结果显示,CTCF-R567W杂合突变小鼠除了幼年时期的瘦小表型外,与野生型小鼠相比没有明显异常,未能很好地模拟临床杂合病例的神经发育障碍行为表型;而携带纯合CTCF-R567W突变的小鼠在出生30分钟内死亡,并表现出大脑、心肺组织的发育异常。研究团队对纯合突变小鼠进行深入研究,发现纯合突变导致神经发育和突触通路紊乱,并揭示纯合突变导致神经祖细胞和放射状胶质细胞等干性细胞过早耗竭,而抑制性GABA能神经元加速发育。
研究团队同时将CTCF-R567W突变引入人胚胎干细胞(hESCs)中,并构建了大脑皮质类器官模型。研究人员发现携带杂合突变的类器官在分化早期表现出神经祖细胞减少和GABA能神经元增加,具有与小鼠模型类似的神经发育失衡现象。这一发现与近期在多个自闭症风险基因的皮质类器官研究中的报道结果相一致,表明CTCF突变可能与自闭症风险因子通过共享的细胞发育通路诱发神经发育障碍。
在分子机制层面上,该研究团队发现CTCF-R567W突变减弱了CTCF在染色质上部分位点的结合(尤其是在具有上游结合基序特征的位点)。这种结合减弱进一步导致了局部染色质结构重组(特别是在对神经元身份识别和神经回路组装至关重要的成簇原钙黏蛋白(cPcdh)基因座)。该基因座由Pcdhα、Pcdhβ和Pcdhγ三个基因簇构成。CTCF-R567W突变主要导致Pcdhβ基因簇多个基因启动子上的CTCF结合减弱,并通过降低远距离启动子与增强子相互作用进而改变了cPcdh基因座的染色质高级结构,使该基因座TAD结构发生分裂,同时伴随着Pcdhβ基因的全局性表达下调,而这些基因的表达异常与神经发育及功能受损密切相关。
该研究阐明了CTCF-R567W突变的作用机制,揭示了CTCF-R567W突变与人类神经发育障碍之间的联系,对理解CTCF突变调节发育障碍的发病机制具有重要意义,并为进一步探索基于三维染色质结构调控的干预方法奠定了基础。
中国科学院广州生物医药与健康研究院为该论文第一完成单位。广州国家实验室姚红杰研究员为该论文通讯作者。中国科学院广州生物医药与健康研究院博士后章杰博士、广州实验室副研究员胡功成博士、中国科学院广州生物医药与健康研究院博士生卢玉丽和山西农业大学博士生任华伟为该论文共同第一作者。该研究工作得到了来自广州国家实验室苗智超研究员、张炜研究员、马宁研究员、刘会生研究员,暨南大学曲宜波教授,安徽医科大学王华教授和张玲玲教授,中国科学院广州生物医药与健康研究院潘光锦研究员以及山西农业大学王海东教授的大力帮助。该研究得到国家自然科学基金、国家重点研发计划等项目的资助。
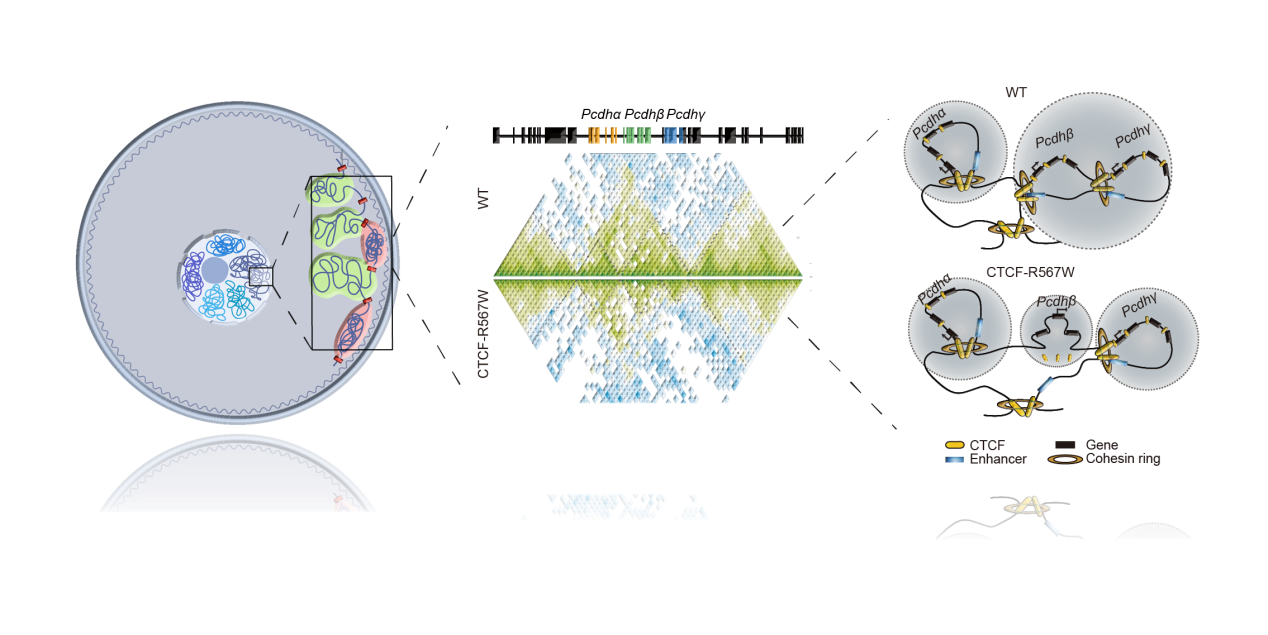
揭示染色质结构蛋白CTCF-R567W点突变导致神经发育障碍的分子机制
附件下载:


