细胞核的核仁是真核生物中核糖体生成的主要场所,核糖体是蛋白质合成的机器。核仁能够快速调整自身结构和功能,以调节细胞内核糖体的数量,从而满足不同生命活动对蛋白质合成的需求。近年来,越来越多的研究表明,核仁是一种能够快速响应外界环境变化的高敏感细胞器。在缺氧、饥饿、氧化应激、紫外辐射、热激等外界应激条件下,核仁会发生形态和功能的退化,并释放大量的核糖体蛋白。这些游离的核糖体蛋白会严重干扰一些细胞核内的信号转导途径,导致细胞周期阻滞、凋亡等应激反应。核仁功能紊乱也常见于许多神经退行性疾病中,如阿尔茨海默症(AD)、帕金森症(PD)、肌萎缩侧索硬化症(ALS)、前额叶痴呆(FTD)等。这些退行性疾病严重威胁到全球数十亿老龄人口的健康。然而,核仁应激如何通过分子机制造成神经细胞损伤,目前尚不完全清楚。

文章上线截图
6月27日,中国科学院深圳先进技术研究院脑认知与脑疾病研所/深港脑科学创新研究院陈宇/陈岳文课题组在Cell Death & Disease上在线发表了题为“Coronin 2B deficiency induces nucleolar stress and neuronal apoptosis”的研究论文。研究团队发现一种新的核仁组分coronin 2B,参与调控核糖体DNA(rDNA)的转录以及核仁应激发生过程。在本项研究中,研究人员采用超分辨率单分子荧光显微成像技术,分析coronin 2B蛋白在神经元核仁中的定位情况,发现其主要富集在核仁的致密纤维组分(DFC),与调控rDNA转录的蛋白Upstream binding factor(UBF)共定位(图1)。
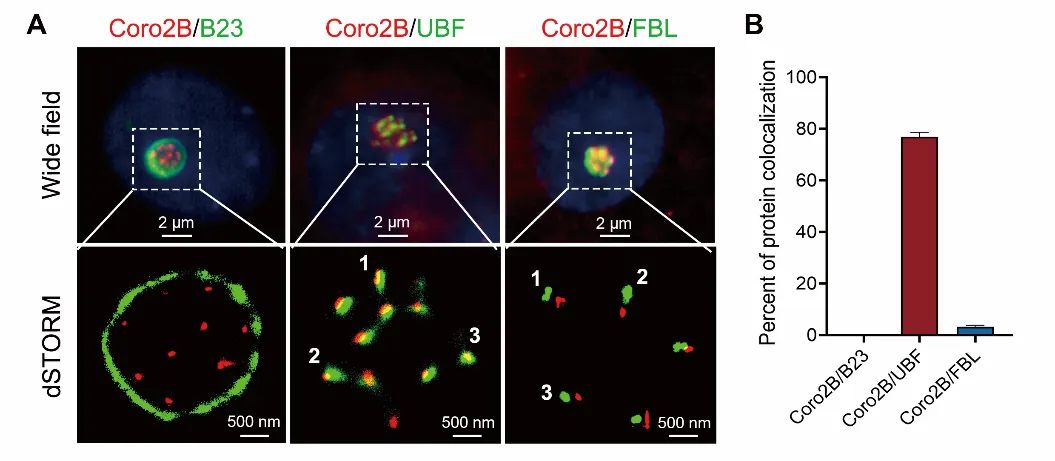
图1. 超高分辨率显微成像分析coronin 2B与核仁不同组分的共定位情况
随后,研究团队进一步发现coronin 2B能够通过与UBF结合来调控rDNA转录起始复合物的组装。在coronin 2B缺陷的情况下,UBF与rDNA转录起始复合物的组分以及rDNA启动子区域的结合能力明显减弱,阻碍了rDNA转录起始复合物的组装,进而抑制rDNA转录水平,引发神经元的核仁应激反应(图2)。
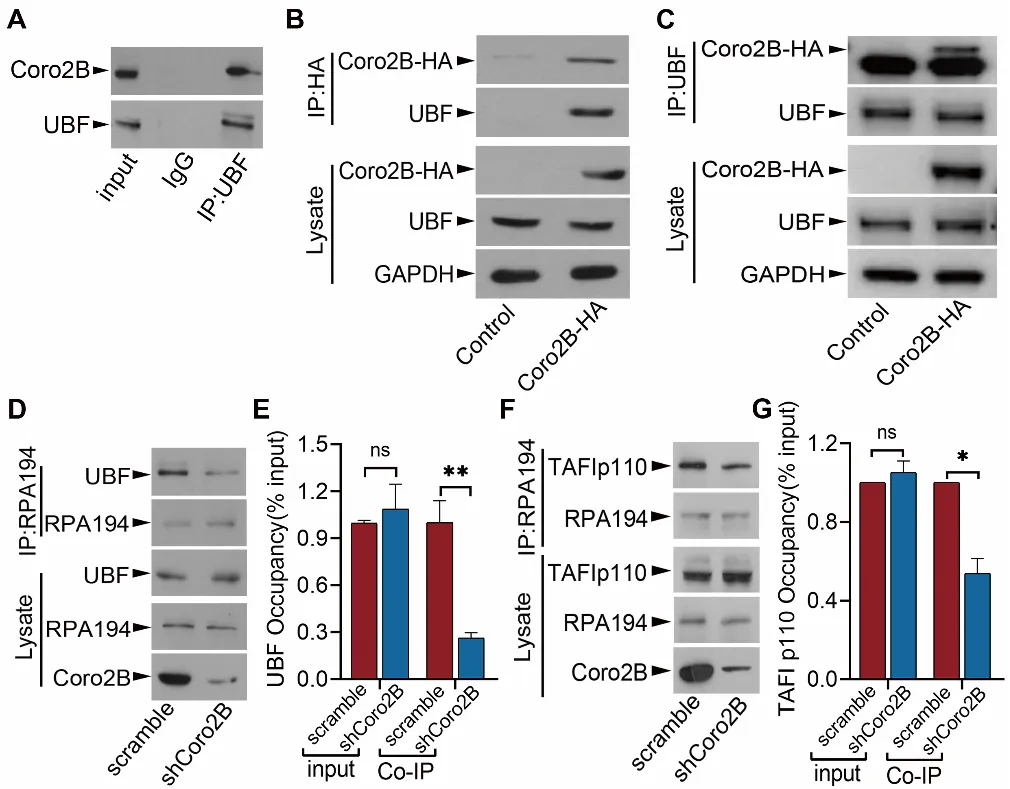
图2. Coronin 2B结合于UBF,调控rDNA转录起始复合物的组装
最后,研究人员发现,coronin 2B缺失引发的核仁应激反应,会抑制p53蛋白的降解,从而导致细胞核内p53的过过度积累与激活,启动细胞凋亡程序,引发神经元的死亡(图3)。
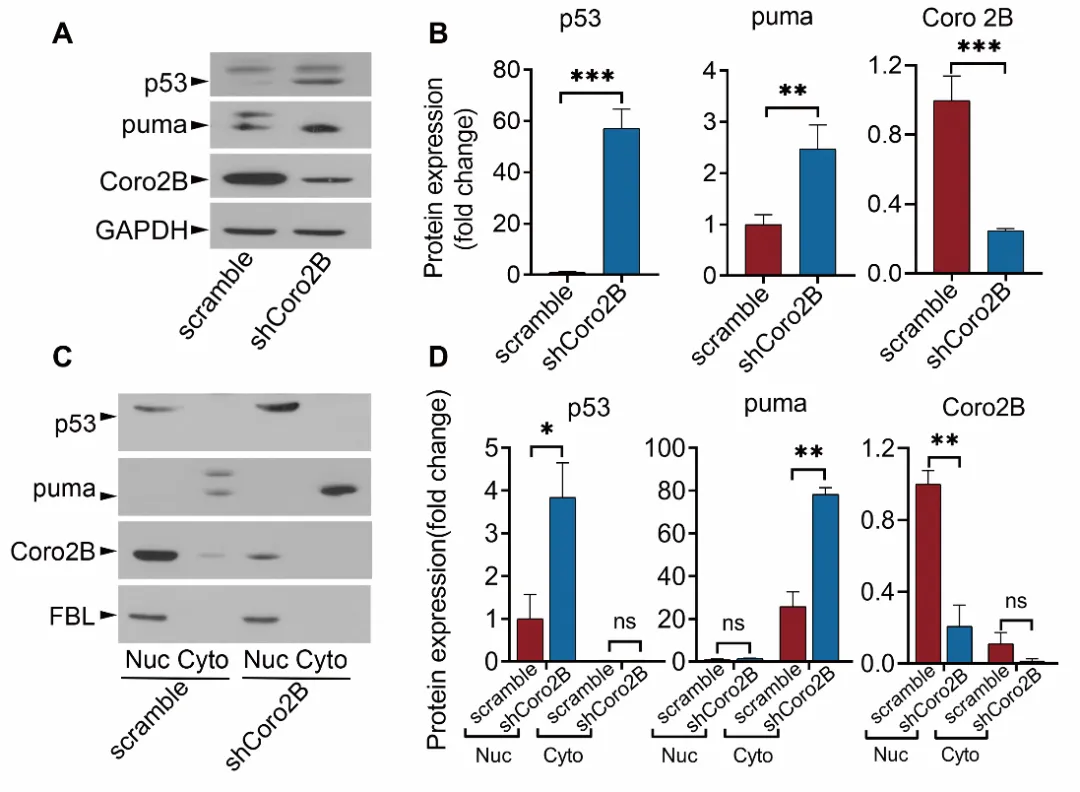
图3. 敲减coronin 2B导致神经元内p53蛋白过渡积累与激活,启动细胞凋亡
综上所述,本项研究发现了一种维持神经元存活的关键核仁组分coronin 2B,解析了其参与调控rDNA转录以及核仁应激发生的分子机理(图4),为探究神经系统核仁应激发生的分子机制及其引发神经退化的机理提供新的线索。本研究不仅增进了人们对rDNA转录调控机制的理解,也将有助于发展基于核仁应激调控的新型神经退行病变干预策略。
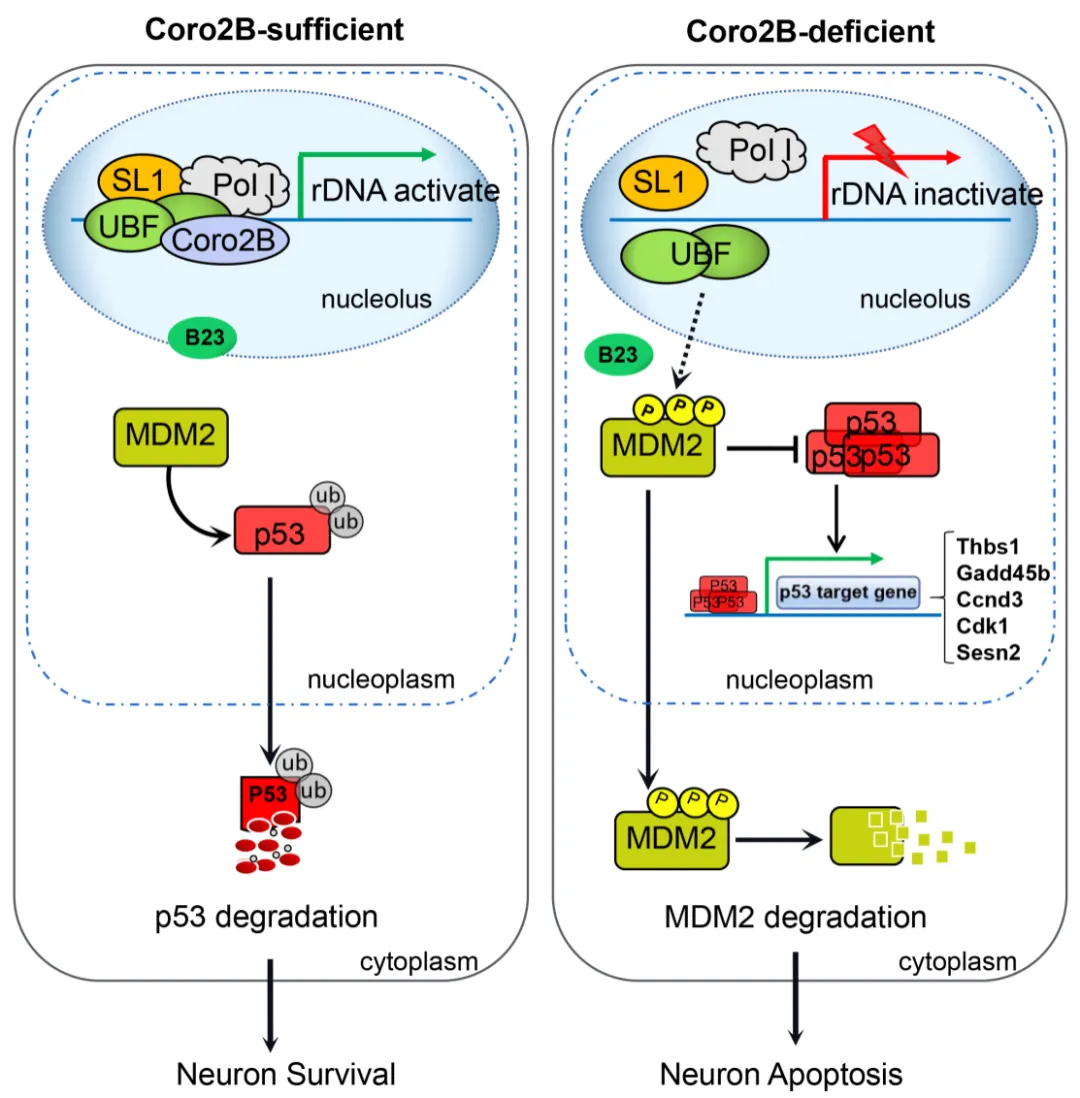
图4. Coronin 2B调控神经元核仁应激反应的分子机制示意图
中国科学院深圳先进技术研究院陈宇研究员、陈岳文副研究员为该论文的共同通讯作者,助理研究员吴红姣为论文第一作者。中国科学院深圳先进技术研究院为第一通讯单位。本研究受到国家自然科学基金委(NSFC)-香港RGC联合基金、广东省粤深联合基金团队项目以及深圳市科创委重点项目等研究计划的资助。
附件下载:


