4月9日,中国科学院广州生物医药与健康研究院刘兴国团队与广州医科大学应仲富团队在Nature Metabolism期刊上发表了一篇题为The mitochondrial unfolded protein response inhibits pluripotency acquisition and mesenchymal-to-epithelial transition in somatic cell reprogramming的文章。揭示了线粒体未折叠蛋白反应(Mitochondrial unfolded protein response,UPRmt)在多能干细胞命运中通过c-Jun调控组蛋白乙酰化,进而影响间充质-上皮转化(MET)的新模式(mitochondrial UPR-modulated MET,mtMET)。这一模式的英文缩写MET是“遇见”的过去式,因此将这一新模式称为“线粒体遇见”。该研究进一步扩展了线粒体反向调控细胞核并调控细胞命运的研究领域。此外,团队证明 UPRmt通过增强上皮-间充质转化 (EMT)促进肿瘤迁移和侵袭,揭示了肿瘤治疗的潜在新靶点。
UPRmt是一条重要的线粒体到核的反向调控途径,线粒体蛋白稳态失衡、活性氧(ROS)升高、线粒体和核基因表达不平衡或者线粒体功能障碍都会激活UPRmt,其激活可以启动由细胞核编码的线粒体热休克蛋白和蛋白酶等基因群转录活化程序,促进线粒体功能在应激反应中的维持。在线虫中UPRmt会延长寿命,然而在哺乳动物细胞中UPRmt在干细胞命运决定和发育中的作用,在很大程度上仍未得到探索。
团队首先全面的检测多能性的不同状态:获得、退出,以及二细胞期-着床前-着床后的状态转换中UPRmt的变化规律。结果表明,多能性获得、退出时, UPRmt具有显著的变化。其中,UPRmt在多能性获得早期阶段短暂激活,随后逐渐减弱。同时发现c-Myc是UPRmt激活的关键因子。c-Myc的过表达能够显著增加UPRmt的标志物Hsp60的表达,而其他转录因子(Sox2、Klf4和Oct4)则没有类似效果。进一步的研究发现,在多能性的获得中UPRmt的激活抑制了MET过程。团队同时也检测了哺乳动物早期分化和肿瘤中,UPRmt同样发挥了调控MET的作用。UPRmt的激活可以增强癌细胞的迁移和侵袭能力。
在机制方面,团队通过筛选获得UPRmt反向调控通路中的全新关键因子c-Jun。c-Jun是一个原癌基因,会抑制多能性的获得,而UPRmt的激活会促进c-Jun的表达。c-Jun通过转录调控,上调乙酰辅酶A代谢酶的表达,从而降低乙酰辅酶A的水平。由于乙酰辅酶A与组蛋白乙酰化密切相关,研究团队进一步发现UPRmt的激活会减少组蛋白的乙酰化,特别是H3K9乙酰化(H3K9Ac)的水平。团队继续发现UPRmt的激活会减少H3K9Ac与上皮样相关基因(E-cadherin和Epcam等基因)启动子区域的结合,这种H3K9Ac水平的降低使得H3K9Ac与上皮样相关基因的结合减少并抑制上皮样相关基因的表达,抑制MET。通过补充乙酰辅酶A的前体物质(如乙酸、柠檬酸和丙酮酸),可以恢复H3K9Ac的水平,并恢复MET相关基因的表达水平。
综上,这项研究首次揭示了在多能干细胞命运调控中UPRmt通过c-Jun降低乙酰辅酶A水平,减少组蛋白乙酰化,进而抑制MET的新通路。这种线粒体调控MET的模式也存在于早期分化和肿瘤领域,是具有广泛性的生物作用模式。
“千锤百炼志如钢,万难不移意未央”,当线粒体面临“压力山大”时,她会悄悄告诉细胞核,细胞核会发出指令改变细胞的“颜值”:能屈能伸的细胞从彼此之间紧密附着的上皮细胞“静若处子”,变为表现出更多的迁移和侵袭能力的间充质细胞“动若脱兔”。而这一细胞变身,联系了UPRmt、干细胞这两大长寿因素,正是“管却细胞变身事,自信人生双甲长”。
本研究是中国科学院广州生物医药与健康研究院、广州医科大学、中国科学院香港创新研究院再生医学与健康创新中心、香港中文大学、山东农业大学、香港大学、西湖大学等多个研究组合作完成。本研究获国家重点研发项目、中国科学院、国家自然科学基金、广东省和广州市的经费支持。
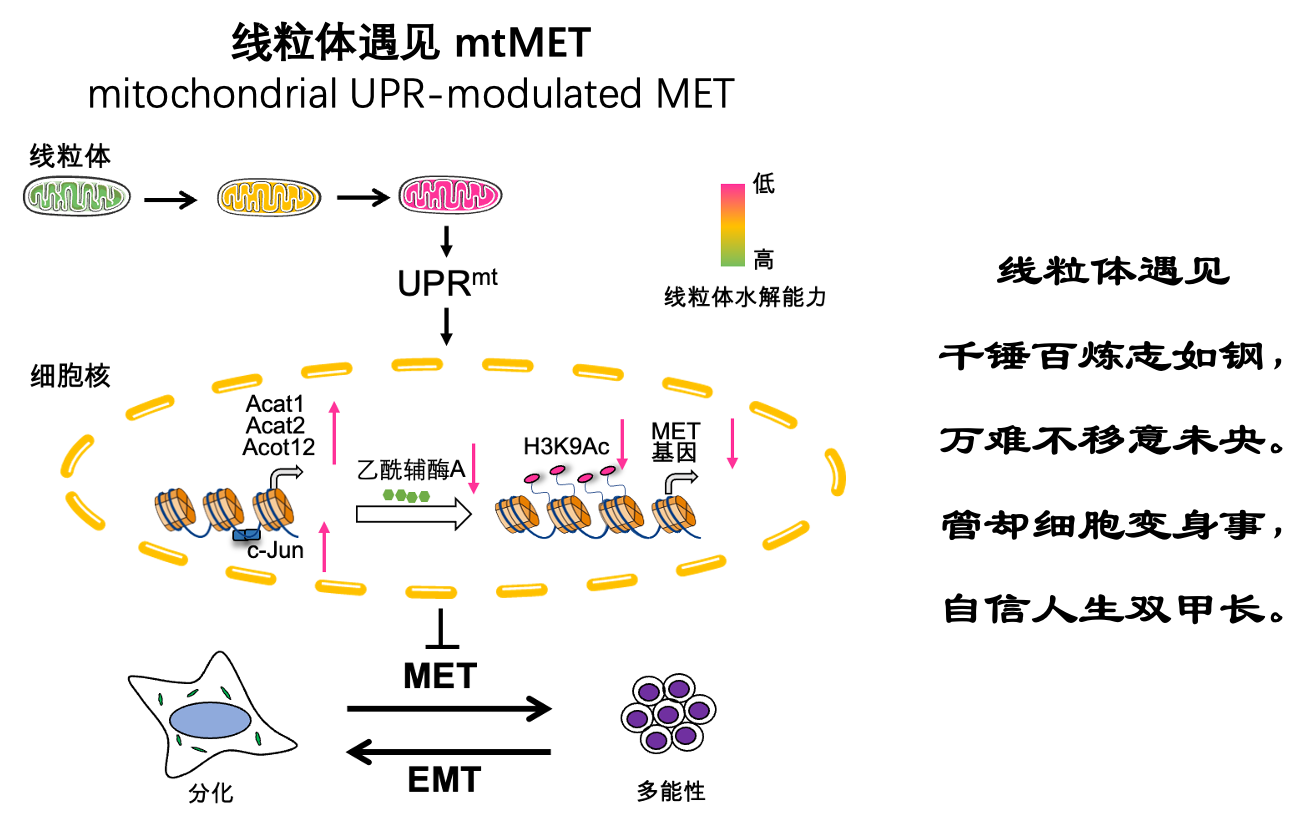
图1 线粒体未折叠蛋白反应通过调控间充质-上皮转化阻碍细胞多能性获得
附件下载:


