近日,中国科学院广州生物医药与健康研究院赖良学/王可品课题组在Signal Transduction and Targeted Therapy杂志上发表了题为In vivo evaluation of guide-free Cas9-induced safety risks in a pig model的研究论文。该研究发现,Cas9蛋白本身在猪体内持续性表达会导致体内基因组损伤、转录组稳态改变和全基因组突变增加,从而引发安全风险。
CRISPR/Cas9系统由Cas9蛋白和单链导向RNA(sgRNA)组成,因其强大的基因组改造能力而备受关注。CRISPR/Cas9系统已被广泛应用于基因功能研究、人类疾病模型构建、作物和家畜生产性能改良等。此外,CRISPR/Cas9介导的基因治疗已被应用于治疗各种遗传性疾病或其他难治性疾病的临床试验中,特别是首款CRISPR/Cas9基因治疗药物的批准上市,标志着CRISPR/Cas9技术已经跨越实验室的门槛,正式步入临床应用的新纪元。
尽管临床试验结果振奋人心,但CRISPR/Cas9介导的基因治疗仍存在重大的安全性风险,包括脱靶、基因组损伤和潜在的免疫原性等。sgRNA依赖的脱靶和基因组损伤已引起了广泛关注,并开发出多种新型基因编辑方法来减低以上风险的发生。然而,有报道显示Cas9蛋白作为外源蛋白,也可以诱发基因组损伤,激活p53相关通路并富集p53失活突变,引发CRISPR/Cas9系统临床应用的额外安全性担忧。目前,对Cas9蛋白本身导致的安全性风险的评估仅限于体外细胞实验研究,而对于在体基因治疗,亟需在体评估Cas9蛋白导致的安全性风险。
猪在器官大小、解剖结构、生理代谢、免疫系统等方面与人非常相似,被认为是评估基因治疗有效性和安全性的理想大动物模型。前期,赖良学课题组培育出了小分子药物灵活调控基因剪刀蛋白Cas9表达的工具猪。利用该工具猪,小分子药物可灵活调控Cas9蛋白在猪体内的表达时间和表达剂量,极大方便了在大动物体内评估Cas9蛋白单独表达导致的安全性风险。
研究人员首先证实,Cas9蛋白在猪体内单独表达会导致体内细胞DNA双链断裂,引起基因组损伤,并且这种损伤程度与Cas9蛋白的表达时间和表达剂量呈正相关。接着,研究人员进一步证实,Cas9蛋白短期(2周)持续体内表达还可导致多器官转录组稳态改变,包括凋亡、细胞周期阻滞、DNA损伤修复等相关信号通路基因的激活。更为重要的是,随着Cas9在猪体内长期表达(5个月到12个月),模型猪出现了生长迟缓和消化功能障碍等异常表型,全基因组测序分析显示,长期表达Cas9蛋白的猪体内基因组突变数量显著增加,并且肿瘤驱动基因突变数量同样高于对照组,表明Cas9蛋白的长期表达不仅影响个体生长发育,还可能增加肿瘤发生的风险。
该研究在大动物体内系统发现了Cas9蛋白的上述新安全风险,提示我们在应用CRISPR/Cas9基因编辑技术进行基因治疗时,还需要充分考虑来源于Cas9蛋白本身潜在的安全隐患。
中国科学院广州生物医药与健康研究院葛维凯博士、苟士学博士,赵筱竹博士研究生和金琴副研究员为该论文的共同第一作者,王可品研究员、赖良学研究员和吴涵副研究员为该论文的共同通讯作者。该研究成果得到了国家重点研发计划、国家自然科学基金、中国医学科学院院外创新单元、海南省重大科技计划、中国科学院青年创新促进会等项目的资助。
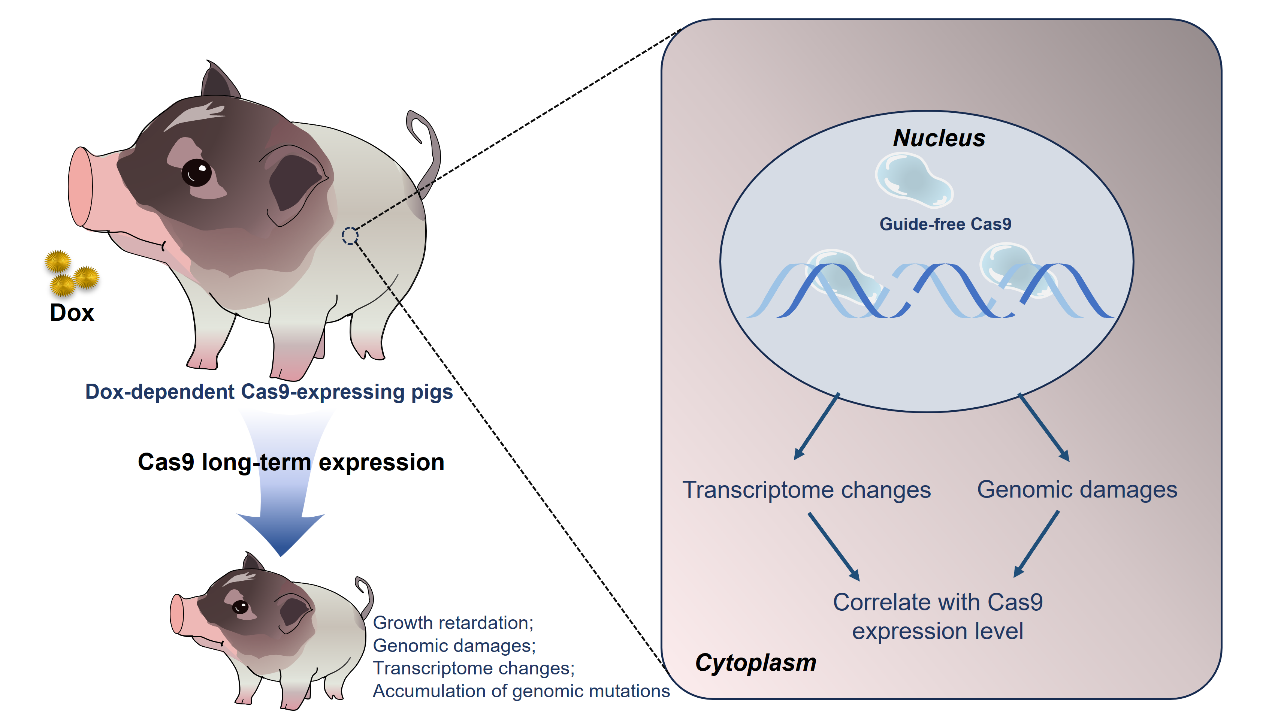
猪体内单独表达Cas9蛋白引发的安全性风险示意图
附件下载:


