近日,中国科学院深圳先进技术研究院喻学锋研究员课题组与暨南大学陈填烽教授等合作,设计合成了一种二维片状结构的靶向纳米体系,实现了肿瘤靶向放射治疗。此项研究成果以题为“Decorated ultrathin bismuth selenide nanosheets as targeted theranostic agents for in vivo imaging guided cancer radiation therapy”(用于成像引导肿瘤放疗的超薄二维纳米诊疗制剂)发表在材料学领域权威刊物NPG Asia Materials (9, e439, DOI:10.1038/am.2017.167,影响因子9.15)上。
放疗作为临床上最常用的肿瘤治疗方法,其疗效受到射线辐射剂量和增敏剂毒性的极大限制。因此,开发高效低毒且同时具备诊断与治疗功能的放疗制剂具有重大意义。喻学锋研究员团队之前在黑磷、硒化铋等二维材料的肿瘤诊疗领域取得了系列研究成果。前期研究发现,硒(Se)是人体必需的微量元素,硒化铋纳米片生物相容性好、并在体内可代谢(Small, 12, 4136, 2016);并且,硒化物纳米材料光热转换率高,且具备多重成像功能(Biomaterials. 11,4848, 2017),因此在肿瘤诊疗领域具有很好的应用潜力。
在本项工作中,研究团队利用铋(Bi,Z=83)大的X射线衰减性能,硒的表面等离子体共振效应、抗肿瘤活性、体内可降解性,设计合成了一种具有二维超薄Bi2Se3纳米片,利用其优良的光热转换效率,实现体内光声成像介导的肿瘤靶向放射治疗。经RGD多肽修饰后该纳米片表现出优越的肿瘤靶向能力、高效的放射增敏作用、体内可降解性和低的肝累积及肝毒性。进一步的增敏机制研究发现,RGD多肽修饰的硒化铋纳米片增敏放疗激活线粒体介导的内源性凋亡通路,在高能X射线作用下可促进细胞内超氧化物阴离子转化成单线态氧,对肿瘤细胞造成原发性损伤,抑制了TrxR活性破坏细胞内氧化还原平衡,抑制了细胞自我修复能力相关蛋白的表达,激活了DNA损伤介导的p53通路,最终引起细胞凋亡。这项研究为成像介导的肿瘤靶向放射治疗提供了一种有效的临床可行方法。
研究工作得到了国家自然科学基金等项目的资助。
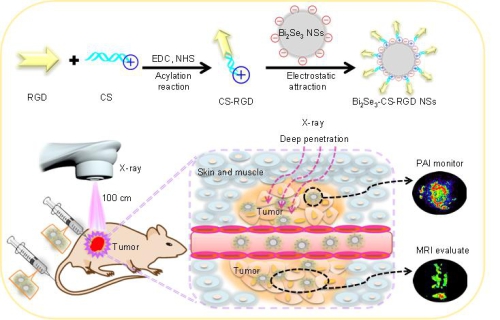
图 靶向硒化铋纳米片用于体内光声成像介导的肿瘤放射治疗设计思路图。
论文链接: http://www.nature.com/am/journal/v9/n10/full/am2017167a.html
附件下载:


