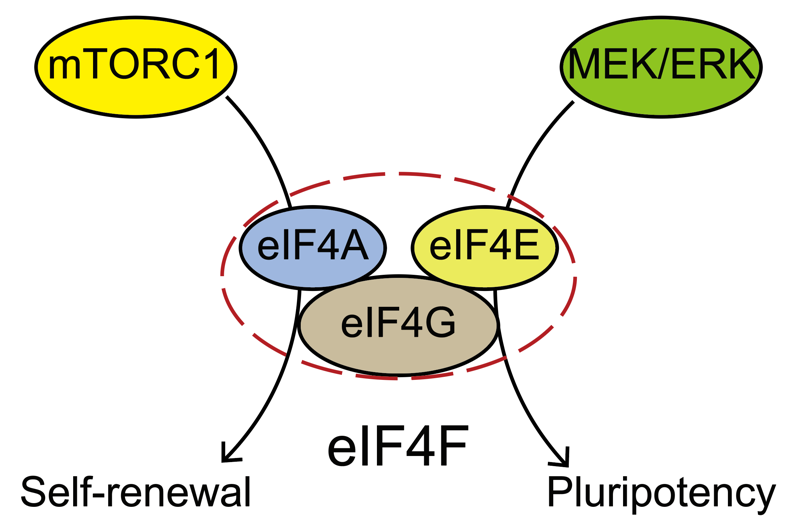
近日,中国科学院广州生物医药与健康研究院秦宝明实验室揭示mTOR调控胚胎干细胞自我更新的新机制,相关成果以The mTORC1-eIF4F axis controls paused pluripotency为题于12月6日发表在EMBO Reports期刊。该工作中,研究人员发现mTOR调控mESC自我更新主要来自mTORC1的作用,具体机制与全基因组转录无关,而主要通过翻译起始复合物eIF4F(eukaryotic translation initiation factor 4F)协同调控细胞质和线粒体的蛋白翻译来实现。因此,内源mTORC1在mESC中维持自我更新而不参与维持多能性。此外,该研究还发现在经典的血清培养条件下,eIF4F还调控多能性蛋白的翻译,这一作用依赖于MEK/ERK通路,而与mTORC1无关。
胚胎干细胞(embryonic stem cell, ESC)具有自我更新(self-renewal)和多能性(pluripotency)这两大重要特征。这两个特征在体内胚胎发育早期对应的阶段都是瞬时存在的。ESC体外建系的过程是胚胎早期细胞在维持多能性的同时获得了几乎无限的增殖能力,即自我更新。早年研究显示,这两大特征相互依存,即多能性维持机制与细胞周期调控之间存在紧密的协同关系。然而近年来一系列新的研究发现,自我更新很大程度上是独立调控的。敲除或阻断Myc、MOF、mTOR等能引发体外胚胎发育以及ESC“pause”(暂停),即细胞增殖停止但多能性维持不变。这一现象在自然界中与哺乳动物胚胎发育中普遍存在的“diapause”(滞育)相对应。利用pause,科研人员可以在胚胎及ESC基因编辑中更加方便地开展实验,甚至有可能建立新的效率更高的相关技术。而深入认识这一特征的调控机制,科研有可能特异性地激活ESC的自我更新并维持多能性不变,这将有助于多能干细胞(PSC)的规模化扩增或生产,推动PSC的基础研究和应用。
2016年,Bulut-Karslioglu等发现在ESC中抑制雷帕霉素机制受体(mechanistic target of rapamycin, mTOR)引发pause,这一作用主要来自包括全基因组转录在内的多个层面的抑制。众所周知,mTOR形成两个蛋白构成和功能迥异的复合物,即mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)来发挥功能,Bulut-Karslioglu等发现两个复合物都参与调控自我更新。然而来自基因敲除小鼠的表型显示,mTOR敲除导致囊胚发育阻断在E5.5天,而mTORC1的失活(Raptor敲除)在同一时间引发胚胎致死,而mTORC2失活(Rictor敲除)则明显更晚引发致死。这提示在胚胎早期发育中mTORC1比mTORC2发挥更为重要的作用。因此,mTOR调控ESC自我更新是通过哪个复合物以及具体机制如何等问题都还尚不清楚。
该成果以mTORC1为切入点,报道了翻译起始调控在ESC自我更新和多能性维持中的作用。值得一提的是,该研究还发现敲降 mTORC1-eIF4F通路中的抑制因子4EBP1/2能显著加速ESC的增殖,说明eIF4F是ESC自我更新的限速调控环节,进一步提示仅仅通过干预eIF4F就可能达到对ESC自我更新的全速域调控。拓展到成体干细胞或功能细胞前体这个范畴,目前这类细胞在体外几乎都无法像ESC那样实现长期稳定扩增,如何激活这类细胞的自我更新同时维持其分化潜能具有重要价值。在机体水平,特异性地刺激体内干细胞的稳态维持,即在体内干细胞反复再生过程中依然维持良好的分化潜能,将对克服疾病和衰老具有重大意义。
秦宝明研究员所带领的代谢与细胞命运实验室,此前致力于研究体细胞重编程早期细胞和代谢重塑的作用和发生机制,曾发现mTORC1介导的生物合成的关闭而非自噬降解的激活是这些重塑过程得以发生以及诱导多能干细胞(iPSC)得以建立的主要原因。
本研究在秦宝明研究员指导下、由广州健康院与中国科学技术大学联合培养的博士研究生徐雪婷完成,并得到了来自中科院生物物理所秦燕教授、浙江大学易文教授、深圳大学的刘宝华教授以及健康院张小飞研究员等多位同行的帮助和支持。该工作得到了来自国家科技部、国家及广东省自然科学基金以及广州市等多项基金的资助。
广州健康院揭示mTOR调控胚胎干细胞自我更新的新机制
附件下载:


