中国科学院广州生物医药与健康研究院刘劲松课题组和中科院南海海洋所张长生课题组合作,解析了Elaiophylin(洋橄榄叶素)生物合成中的糖基转移酶ElaGT对称加糖的机制。相关研究成果近日以Substrate-induced dimerization of elaiophylin glycosyltransferase reveals a novel self-activating form of glycosyltransferase for symmetric glycosylation为题发表在国际晶体学会期刊Acta Cryst. D Struct Biol上。
Elaiophylin是一种含有16元环的天然大环内酯类抗生素,具有独特的C2对称性,两端各有一个脱氧糖基。该抗生素结构新颖,具有广谱的抗菌及抗肿瘤活性等,因此引起广泛关注。ElaGT(elaiophylin glycosyltransferase)是负责elaiophylin糖基对称转移的酶,是潜在的酶学工具,可扩展Elaiophylin及类似物的结构多样性和活性。
研究通过解析4种状态的ElaGT的结构发现ElaGT在底物诱导下可以形成一种具有连贯通道的二聚体,该通道长度可允许一个Ela分子在通道内穿梭。进一步的结构分析和生化实验发现,该二聚体的组装方式与激活子依赖型糖基转移酶中酶和配体的作用模式类似,其二聚界面可以间接调控糖基结合位点。因此,该酶可能采用的是一种自激活二聚化模式识别并催化糖基转移。该界面通过多个甲硫氨酸相互作用,突变其中的一个甲硫氨酸可以明显改变该酶的聚合方式以及结合Ela的能力,这进一步提示该界面是潜在的酶活以及底物特异性的调控位点。
该研究为探索同源糖基转移酶合成具有不同糖基组成和具有新颖活性的类似物提供新思路。
广州健康院刘劲松课题组的副研究员许婷婷以及助理研究员甘庆庆为该文的共同第一作者,刘劲松研究员为通讯作者。该研究获得呼吸疾病国家重点实验室、中科院青促会、广东省生物医药计算重点实验室、广东省自然科学基金等项目的经费支持。
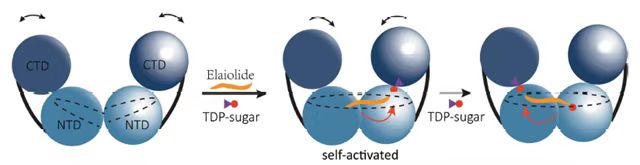
ElaGT自激活对称加糖的模型图
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1107/S2059798322008658?sentby=iucr
附件下载:


