类风湿性关节炎 (RA) 是一种直接影响关节的慢性自身免疫性疾病。症状包括因骨骼、软骨和滑膜的炎症损伤而引起的肿胀和变形[1]。RA还可能导致心血管、肺部、心理和骨骼疾病[2]。虽然RA的确切病因尚不清楚,但已证实在RA发生发展过程中包括多种促炎细胞因子的高表达、活性氧 (ROS) 的过度产生以及RA炎症低氧微环境的形成等[3]。传统的抗风湿治疗药物主要包括非甾体抗炎药(NSAIDs)、抗风湿药(DMARDs)和糖皮质激素[4]。最近,有报道通过生物制剂(如英夫利昔单抗和托珠单抗)抑制促炎因子如肿瘤坏死因子-α (TNF-α) 和白细胞介素 6 (IL-6) 等对传统抗风湿药低应答的RA患者有较好的治疗作用(研究团队此前相关研究Advanced Materials, 2020, 2003399)[5]。这些治疗方式表明了抑制 RA促炎因子的重要性。但针对复杂多样的促炎因子,生物制剂的特异性仍无法满足治疗需求,且也无法调控对RA发生和发展有重要促进作用的低氧等微环境。因此,研究一种对RA微环境具有特异、高效诊疗作用的新方法至关重要。
近日,中国科学院深圳先进技术研究院(简称“深圳先进院”)与美国德克萨斯大学奥斯汀分校研究团队在PNAS上联合发表研究成果,提出了一种基于仿生递送体系的类风湿关节炎诊疗新策略。

文章上线截图
该研究联合使用小干扰RNA(siRNAT/I)和普鲁士蓝(PB)来沉默促炎细胞因子TNF-α/IL-6的表达,并清除RA微环境中过表达的ROS,同时缓解乏氧状态。为了提高siRNAsT/I和PB在体内的稳定性、生物相容性和炎症靶向性,研究人员通过提取内源性巨噬细胞,然后刺激其产生具有同源性的膜囊泡作为仿生载体,合成了一种具有诊疗一体化功能的综合平台—M@P-siRNAsT/I(图1)。
类风湿关节炎体外靶向识别机制研究。细胞膜囊泡作为药物递送系统具有天然优势,因为它们源自内源性细胞,具有良好的生物相容性以及较小的免疫原性。此外,由于炎症细胞对炎症组织固有的趋向性,因此对于药物的靶向递送具有潜在的特异识别效果。研究人员首先在细胞层面对M@P-siRNAsT/I的靶向性进行探索。研究发现,相比商用化脂质体作为载体的治疗体系,M@P-siRNAsT/I对血管内皮细胞、滑膜成纤维细胞具有更高的靶向识别能力。机制研究发现,M@P-siRNAsT/I主要通过主动识别血管内皮细胞表面P选择素以及ICAM-1特异蛋白,进而靶向识别激活的成纤维细胞(图2)。该研究表明了仿生膜递送体系具有独特和高效的炎症细胞识别能力。
类风湿关节炎体外治疗研究。相比传统抗体类治疗药物,siRNA可以与 mRNA序列特异性配对,从源头抑制促炎因子相关基因的表达。此外,针对类风湿关节炎微环境过表达的ROS以及乏氧特点,研究人员使用了具有催化酶特性的普鲁斯兰,不仅可以清除ROS,还可以催化过氧化氢产生氧气,进而调控RA微环境。通过仿生膜体系的递送,同时提高了siRNA/普鲁斯兰的稳定性和靶向能力。结果证实,M@P-siRNAsT/I在TNF-α/IL-6/ROS等多炎症因子的表达、滑膜成纤维细胞的迁移和新生血管形成方面发挥了很好的抑制效果(图3)。
类风湿关节炎体内靶向光声成像研究。普鲁斯兰不仅具有催化酶作用,还具有很好的近红外光声成像特性。研究人员首先构建了一种CIA类风湿关节炎小鼠模型,通过近红外光声成像对M@P-siRNAsT/I的体内行为进行三维实时监测。结果发现,相比商业化脂质体递送体系,M@P-siRNAsT/I可以高效的在类风湿关节炎足爪关节聚集,充分展示了仿生递送体系的炎症靶向能力(图4)。
类风湿关节炎体内治疗和疗效评估研究。该研究首先通过传统的micro-CT、病理染色、临床评分等方法对治疗后的关节病灶中骨及软骨破坏、免疫和炎症细胞浸润、炎症因子表达水平进行了检测,发现M@P-siRNAsT/I具有很好的在体治疗效果。同时,研究人员通过无标记多光谱光声成像方法对关节病灶的血氧饱和度进行连续监测,发现治疗后的关节病灶乏氧状态得到有效缓解,这一结果得到乏氧相关蛋白HIF-1α的组织免疫荧光染色的进一步证实(图5)。
综上所述,本研究在类风湿关节炎治疗策略方面,突破了传统思路,针对复杂多样的炎症微环境,创新性抑制多个促炎因子相关基因的表达,同时调控RA炎症微环境,清除ROS、缓解乏氧等,起到“双管齐下”的治疗效果;在RA微环境靶向识别方面,利用内源性仿生递送体系天然的炎症趋向特性,解决了基于传统供受体特异识别策略所存在的易脱靶的困境;在成像引导和治疗评估方便,采用光声成像技术,解决了荧光成像在关节成像时穿透浅、无深度信息的难题,可以获取关节病灶三维实时分子信息,为RA的在体精准治疗提供图像信息,同时还可以对治疗时的血氧等功能信息变化进行监测,为RA的预后评估提供有效的影像学手段。
本论文第一作者为深圳先进院和香港中文大学第二附属医院(深圳市龙岗人民医院)联合培养博士后陈建海博士。通讯作者为深圳先进院陈敬钦副研究员、刘成波研究员和美国德克萨斯大学奥斯汀分校Jonathan L. Sessler教授。深圳先进院为文章的第一单位。本工作特别感谢深圳先进院张鹏研究员和宋亮研究员、牛津大学Adam博士、龙岗人民医院王本国教授、深圳人民医院张海教授、南方医科大学方驰华教授的指导和大力支持。本工作得到了国家自然科学基金、科技部重点研发计划、中科院健康信息学重点实验室、广东省分子影像学重点实验室以及美国Robert A. Welch基金的支持。
参考文献
1.S. A. Jones, B. J. Jenkins, Recent insights into targeting the IL-6 cytokine family in inflammatory diseases and cancer. Nat Rev Immunol 18, 773-789 (2018).
2.G. R. Burmester, J. E. Pope, Novel treatment strategies in rheumatoid arthritis. The Lancet 389, 2338-2348 (2017).
3.K. Chaudhari, S. Rizvi, B. A. Syed, Rheumatoid arthritis: current and future trends. Nat Rev Drug Discov 15, 305-306 (2016).
4.E. V. Arkema et al., Are patients with rheumatoid arthritis still at an increased risk of tuberculosis and what is the role of biological treatments? Ann Rheum Dis 74, 1212-1217 (2015).
5.J. Chen et al., Tocilizumab–Conjugated Polymer Nanoparticles for NIR-II Photoacoustic-Imaging-Guided Therapy of Rheumatoid Arthritis. Adv Mater 32, 2003399 (2020).
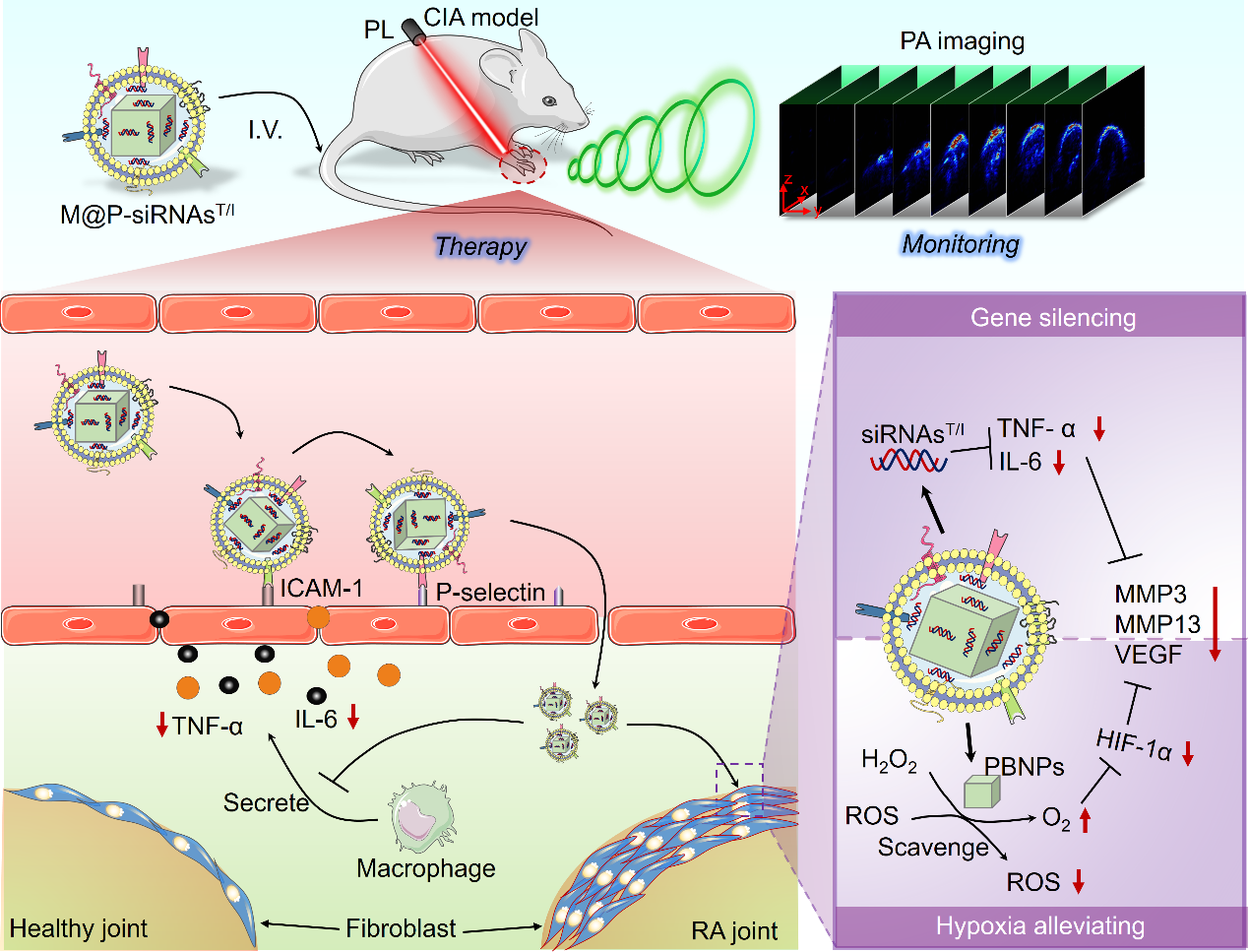
图1. 类风湿关节炎靶向诊疗研究示意图
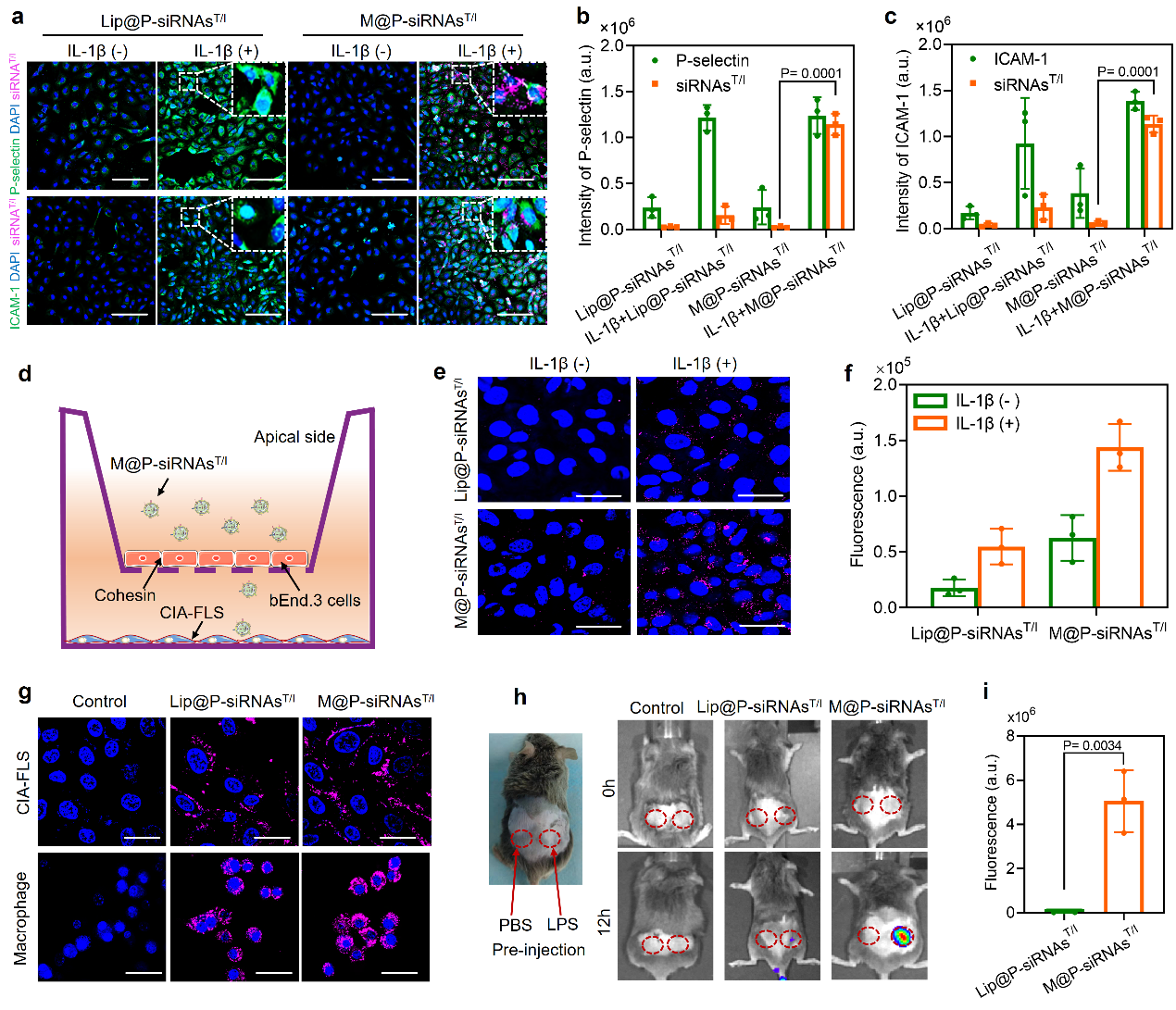
图2. 仿生递送体系的体外靶向研究
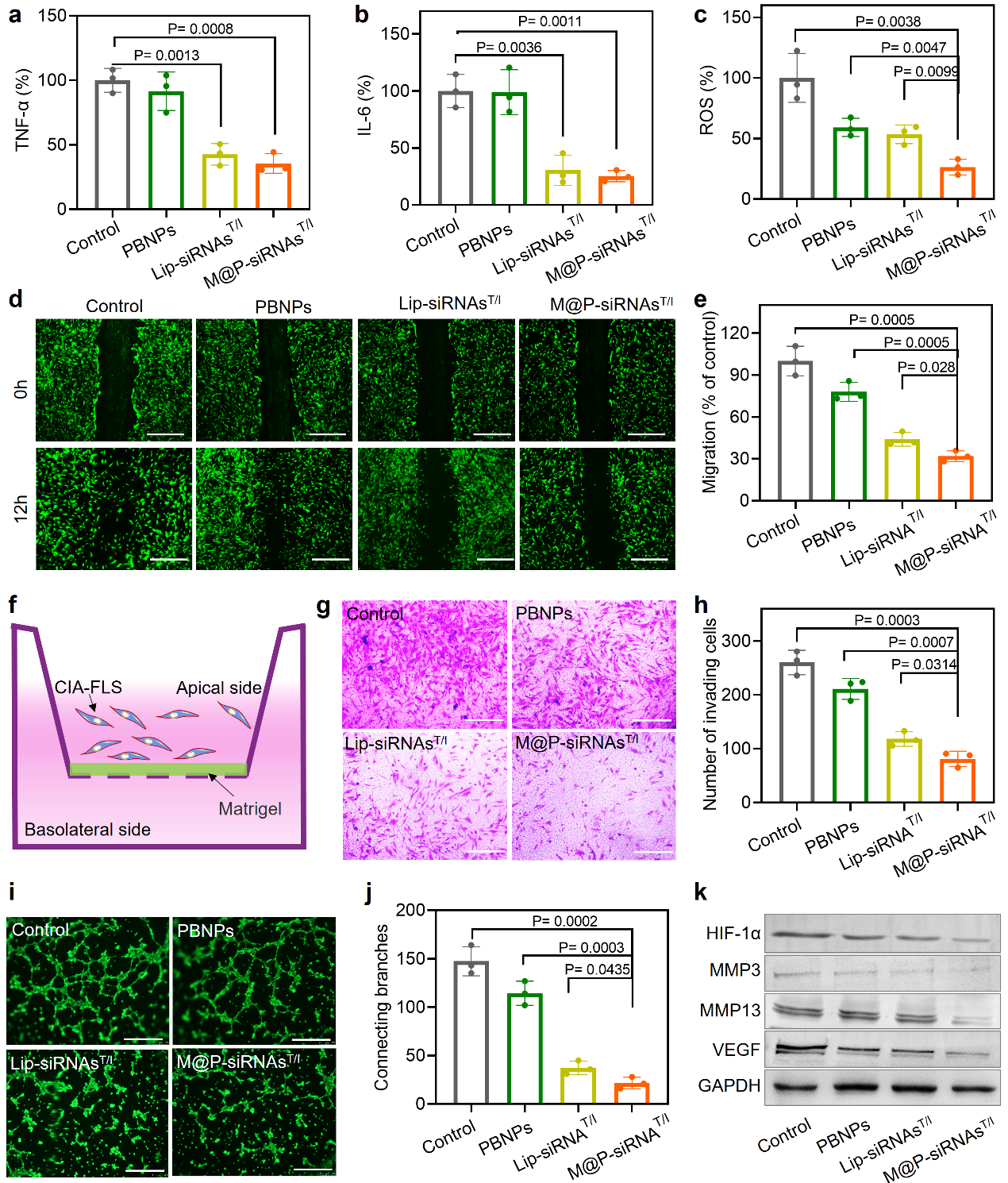
图3. 类风湿关节炎体外治疗研究
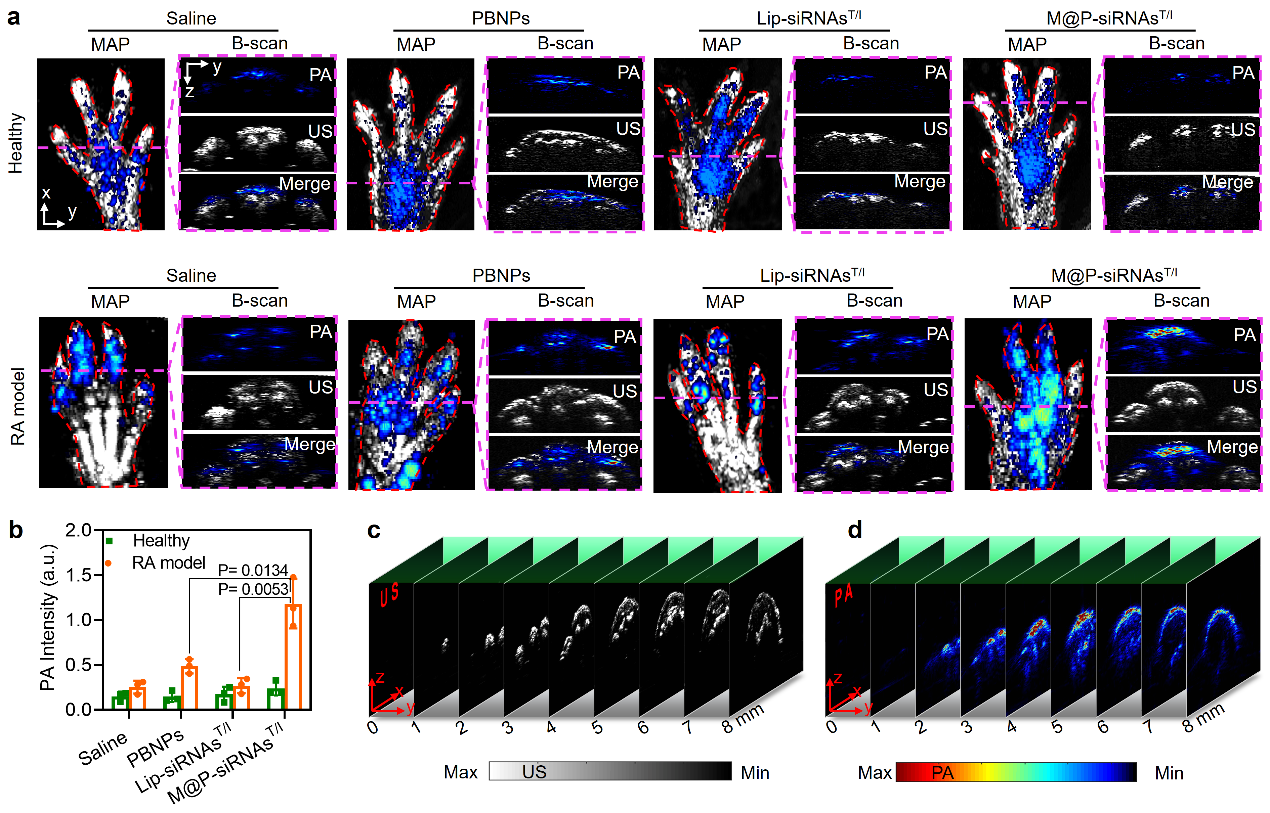
图4. 类风湿关节炎体内靶向光声成像研究
附件下载:


