近日,中国科学院广州生物医药与健康研究院与澳门大学合作在Cell Reports在线发表题为Vibrio parahaemolyticus prey targeting requires autoproteolysis-triggered dimerization of the type VI secretion system effector RhsP的研究论文。研究发现,肠炎弧菌效应蛋白RhsP形成一个桶状结构,通过自水解引发桶内VIR(VgrG2-interacting region)肽段明显的构象变化,并进一步证明这一构象变化促进了RhsP二聚体的形成,释放核酸酶毒素,提示RhsP以自水解发生构象变化进而促进二聚体形成来靶向猎物细胞这一分子机制,为潜在新型抗感染手段的开发提供了分子机制和理论基础。
细菌Ⅵ型分泌系统(Type VI secretion system, T6SS)广泛存在于革兰氏阴性菌中,其构造类似于噬菌体尾管,主要通过挂载并分泌不同的毒素效应蛋白来攻击猎物细胞并取得菌群竞争优势。其中Rhs家族蛋白是一类大型效应蛋白,通过其C端的核酸酶毒素切割猎物细胞DNA以达到杀死猎物的目的。同时,在毒素效应蛋白基因组的下游通常伴随可以中和其毒性的免疫因子的表达,这也使得携带Rhs毒素的细菌能够保护自身不受影响。T6SS如何分泌Rhs这样的大型效应蛋白的分子机制一直是领域内的热点和难点,而Rhs家族效应蛋白如何释放核酸酶毒素这一过程也未得到明确的解析。
本研究首先在致病性肠炎弧菌中发现了一个能够自水解的T6SS效应蛋白RhsP,进一步通过生化实验发现RhsP自水解为三个片段,N端、 Rhs桶和具有核酸酶毒性的C端(图1A)。为了解答自水解这一过程对RhsP的分泌和核酸酶毒素释放的作用,团队利用单颗粒冷冻电镜技术获得了RhsP自水解后(cleaved RhsP)和RhsP自水解前(Uncleaved RhsP)的高分辨结构(图1B)。对自水解前后的RhsP的高分辨结构分析后发现,Rhs区域形成了一个封闭的桶状结构。N端肽段从桶盖顶部缝隙延伸出去,提示N端水解后的离开轨迹(图2A)。另外,发生水解后的VIR在构象上发生了巨大变化,它以U形在桶内伸展并将含有核酸酶毒素的VIR-C端送出到桶盖上移引起的缺口处(图2B)。最后,通过结构分析发现VIR结合β-sheet的疏水内表面,通过构建VIR-C端F1208A/Y1209A突变株验证了RhsP自水解后引发VIR构象变化促进二聚体的形成。
本研究通过生化实验和冷冻电镜等手段,捕捉了效应蛋白自水解前后瞬间的构象变化,发现RhsP的自水解过程引发了Rhs桶状结构的构象变化,揭示了释放核酸酶毒素的分子机制,同时也发现了VIR区域构象变化促进的RhsP二聚体形成,是其靶向猎物细胞的关键步骤(图3)。
澳门大学博士后唐乐、中国科学院广州生物医药与健康研究院博士生董淑琦、澳门大学博士后Nadia Rasheed和博士生胡巧颖、生物岛实验室科研助理周宁坤为本文共同第一作者。澳门大学William Chong Hang Chao教授、中国科学院广州生物医药与健康研究院何俊研究员和澳门大学郑军教授为本文的共同通讯作者。该研究得到了澳门大学、澳门特别行政区科学技术发展基金以及国家自然科学基金、广东省自然科学基金等的资助。
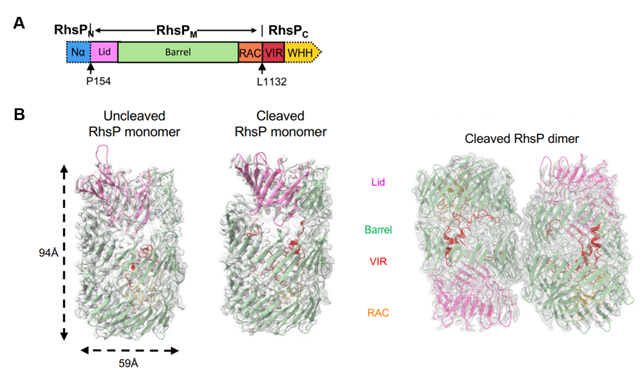
图1 A: 毒素效应蛋白RhsP结构域示意图,B: RhsP自水解前后高分辨蛋白结构图
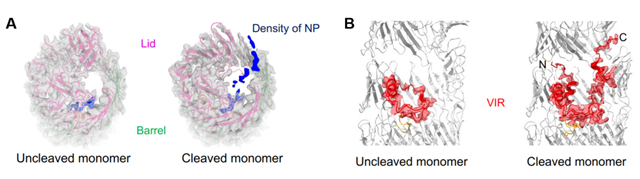
图2 A: RhsP自水解前后N端肽段轨迹图,B: RhsP自水解前后VIR构象变化图
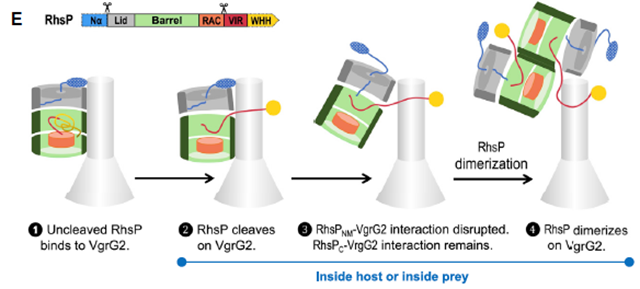
图3 RhsP自水解引发的二聚体形成并靶向猎物细胞的步骤模型
附件下载:


