转移是导致90%以上癌症病人治疗失败和死亡的原因。其中非小细胞肺癌(NSCLC)患者中约1/3会发生脑转移。与其他转移部位不同,脑转移需跨越血脑屏障,既影响肿瘤细胞的适应性,也限制治疗方案的选择。既往关于转移的基因组学研究,主要基于非配对原发和转移的肿瘤突变图谱比较。然而,这种研究策略难以鉴定原发灶中驱动转移的突变基因,同时难以解析转移的演化规律和适应性。因此,系统分析和比较同一病人的原发灶和多器官转移灶的基因组学,阐明转移器官趋向性的基因组学特征与演化规律,具有重要意义。
近日,中国科学院深圳先进技术研究院合成生物学研究所胡政、广东省人民医院/广东省肺癌研究所钟文昭和中山大学肿瘤防治中心牟永告团队在Cell Reports在线发表题为“Deciphering genomic evolution of metastatic organotropism with 535 paired primary lung cancers and metastases”的研究论文。报道了对223例非小细胞肺癌基因组测序数据(共885个原发/转移配对肿瘤样品)的分析结果,揭示了不同转移部位的克隆起源、转移趋向性决定基因以及转移灶中观察到由杂合性丢失驱动的“早期驱动突变丢失”现象。
首先,研究者通过整合团队自主数据和公共数据,构建了大规模的配对原发-转移全外显子组数据队列(图1),涵盖223个配对原发肿瘤、94个脑转移(BM)、39个远处颅外转移(ExM)和179个淋巴结转移(LNM)。
结果显示,原发与配对转移灶的肿瘤驱动突变总体高度一致,但有趣的是,与未转移的早期原发肿瘤相比,肺癌脑转移配对的原发肿瘤中富集PTPRD、FAT1等突变基因(图2A),且在原发阶段即呈更高的突变克隆性(图2B-D),提示这些驱动基因可能在转移启动前已赋予器官转移趋向性。
然后,研究者通过团队之前开发的转移克隆性计算框架,比较原发/转移灶中携带突变的肿瘤细胞比例(cancer cell fraction或CCF),解析了转移的克隆起源模式,即单克隆起源(monoclonal seeding)或多克隆起源(polyclonal seeding)(图3A)。单克隆起源指转移由原发灶中的单个细胞发起(“单兵作战”),而多克隆起源指转移由多个细胞发起(“团队协作”)。研究者发现多克隆起源在脑转移中相比于其他转移中相对较为普遍(图3B左),且药物治疗并不影响这一结果(图3B右)。该结果表明脑部的独特结构(例如血脑屏障)导致原发灶肿瘤细胞在转移过程中面临高强度的选择压力,造成了显著的瓶颈效应。
最后,在多例配对进化树中,研究者鉴定到转移灶通过特异性LOH而丢失原发阶段即存在的早期驱动突变,提示转移微环境可能对部分“原发适应性驱动”施加负选择,导致早期在原发部位获得的驱动突变在转移灶丢失(图4)。
总之,该研究通过系统地分析不同转移部位、大规模原发-转移配对测序数据,揭示器官转移趋向性驱动基因突变在原发阶段即已存在,跨越血脑屏障的强瓶颈效应使脑转移倾向于以单克隆转移,而转移后又可能通过LOH“丢失”原发肿瘤获得的早期驱动突变。这些发现为肺癌脑转移风险预测和早期靶向干预提供了指导。
中国科学院深圳先进技术研究院合成生物学研究所胡政研究员、广东省人民医院/广东省肺癌研究所所长钟文昭教授和中山大学肿瘤防治中心神经外科牟永告教授为本文共同通讯作者。中国科学院深圳先进技术研究院-澳门大学联合培养博士研究生解铎;中山市人民医院心胸外科主治医师、广东省肺癌研究所博士研究生唐文芳;同济大学附属上海市肺科医院蒋涛教授;中山大学肿瘤防治中心神经外科副主任医师段昊博士为论文的共同第一作者。该项研究成果获得国家自然科学基金、广东省自然科学基金、深圳合成生物学创新研究院等项目的资助。

文章上线截图
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01220-3
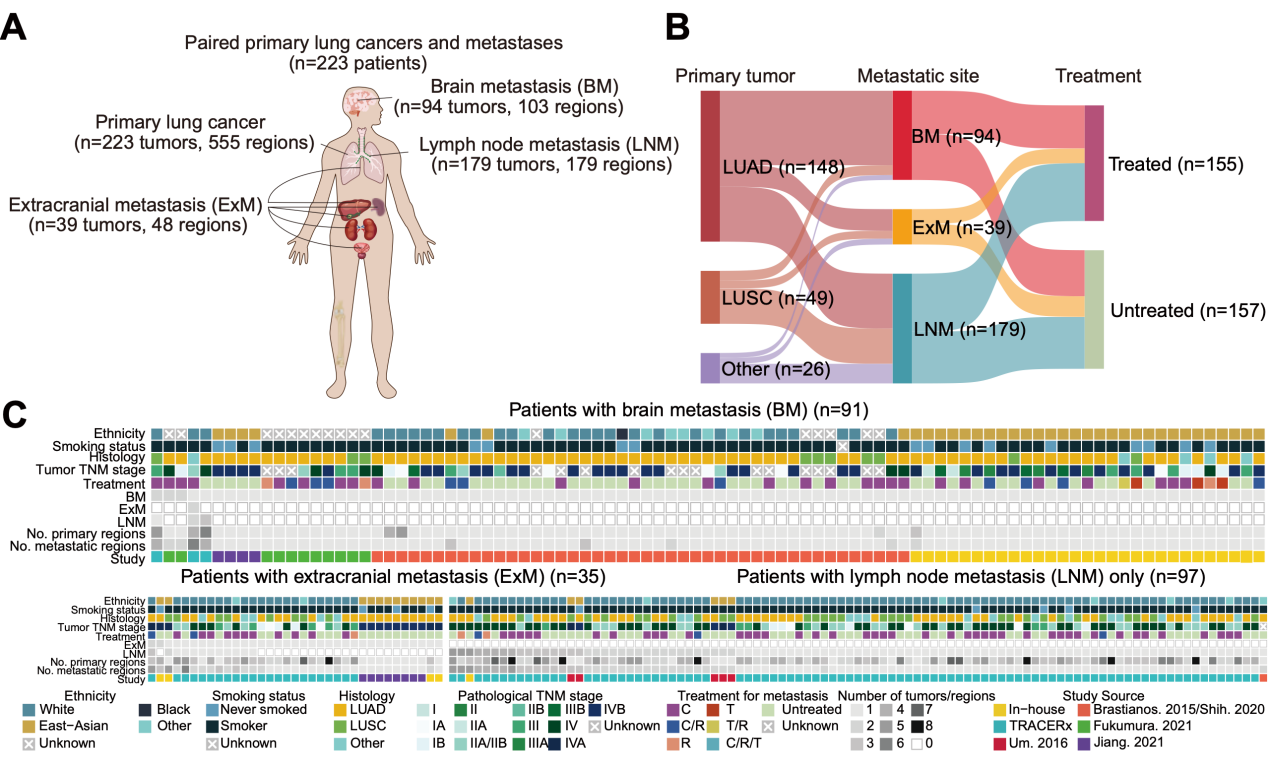
图1. 223例转移性非小细胞肺癌的原发-转移配对基因组数据集
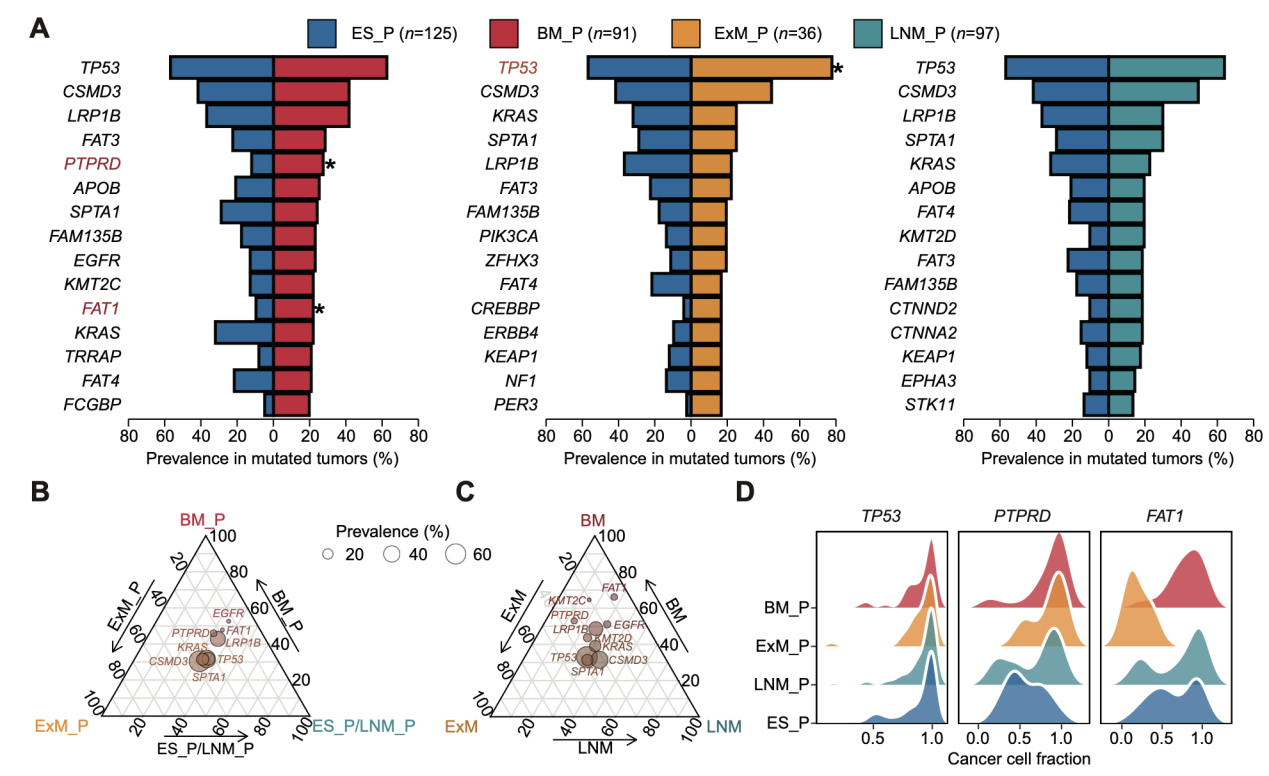
图2. (A)发生脑转移的原发灶vs早期肺癌的驱动突变基因比较;(B-C)驱动突变基因在不同原发灶(B)和转移灶(C)的相对丰度;(D)驱动突变基因的克隆性
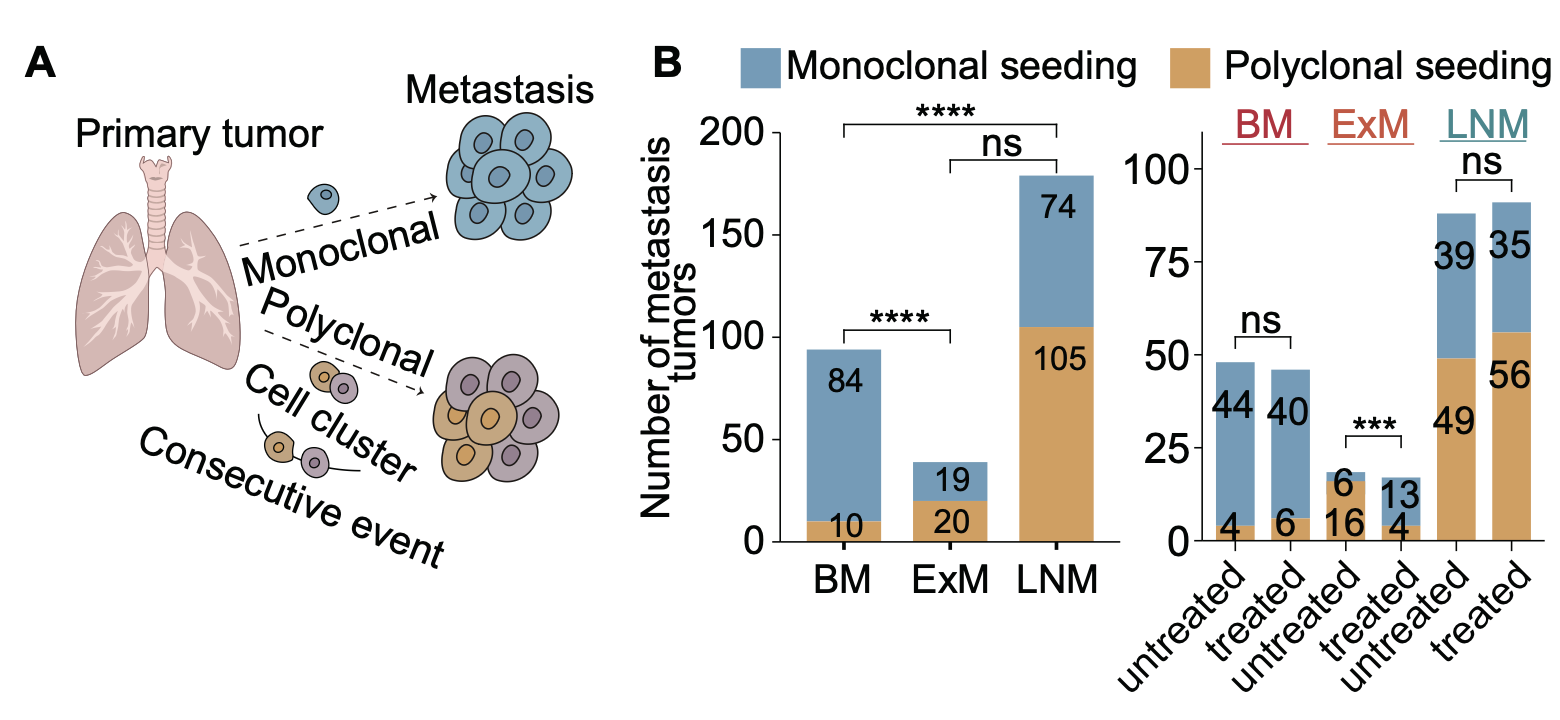
图3. 非小细胞肺癌不同转移灶的定植克隆性
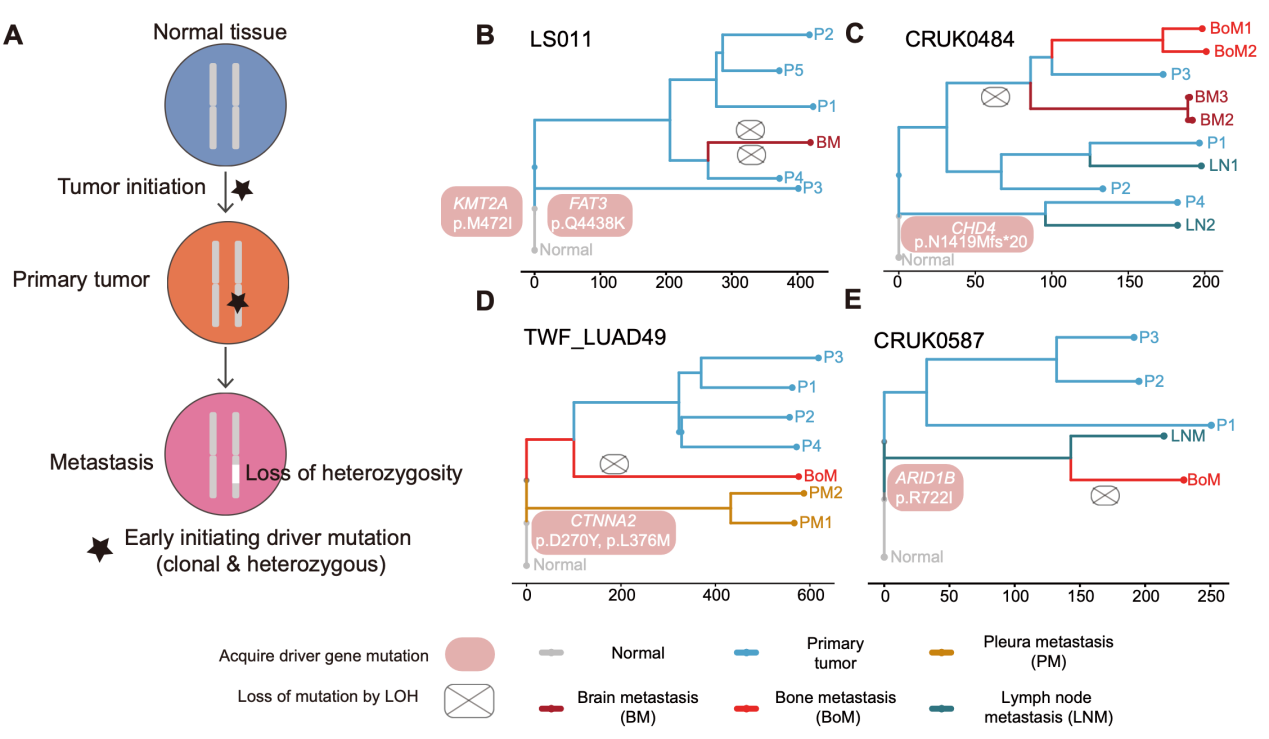
图4. 杂合性丢失引起的的早期驱动突变丢失
附件下载:


