反刍动物(如牛、羊、鹿等)依赖其复杂的胃肠道微生物群落消化纤维类物质,合成挥发性脂肪酸和微生物蛋白,同时排放温室气体甲烷。以往研究多集中于细菌和古菌群落,而对数量庞大的病毒群落了解甚少。病毒通过侵染宿主、调节代谢、传递基因等方式,深刻影响微生物群落结构和功能,但反刍动物胃肠道不同区段的病毒组成、分布及其生态功能仍属未知。
该研究整合了来自7种反刍动物10个胃肠道区域的373个宏基因组样本,结合二代与三代测序技术,成功构建了首个反刍动物胃肠道病毒组目录(Ruminant Gastrointestinal Virome Catalog,RGVC)。该目录包含近4.4万个病毒分类单元(vOTUs),其中90%为以往未知的新病毒,并成功鉴定出大量由长读长技术捕获的超大基因组病毒(长达1000 kb)(图1),极大地拓展了人们对反刍动物肠道病毒世界的认知边界。
该研究发现,病毒群落组成并非随机分布,而是呈现出鲜明的空间异质性,这种差异主要取决于胃肠道所在的生理区段,而不是反刍动物宿主种类(图2)。进一步通过生物信息学分析,发现超过4600个原核生物宿主与近6000个病毒之间上万对的高置信度匹配,揭示了病毒与宿主之间广泛而复杂的互作网络。深入分析表明,胃肠道病毒的丰度与其对应宿主的丰度呈现高度一致性,不同胃肠道之间的原核微生物群落差异是导致病毒呈现空间异质性的主要原因(图3)。近半数的病毒倾向于采用溶原性生活方式,即将其基因组整合到宿主染色体中与之长期共存,且这种生活方式的比例在不同胃肠道区域中呈现规律性变化。病毒携带的辅助代谢基因(Auxiliary Metabolic Genes,AMGs)广泛参与碳水化合物降解、能量代谢等关键途径,具有重要的代谢调控潜力,且在不同胃肠段间呈差异分布。进一步研究通过基因邻域分析和蛋白质三维结构模拟(AlphaFold3),排除了宿主基因污染,验证了这些AMGs的病毒来源及其功能的可靠性(图4)。 这些结果表明,溶源病毒与宿主建立了互利共生关系,共同调节反刍动物的营养吸收与能量获取。
该研究首次从“空间异质性”这一生态学核心视角出发,系统揭示了反刍动物胃肠道病毒群落的分布规律、生存策略与功能贡献。对病毒群落区域特性的解析,不仅拓展了人们对宿主‑微生物‑病毒互作的认识,也为未来通过干预特定胃肠道区段的病毒活动,从而提升饲料转化效率、定向减少甲烷排放,提供了新的科学路径与潜在调控靶点。
该研究成果发表于Journal of Advanced Research(综合性期刊1区Top,IF = 13.0),亚热带生态所博士研究生张诗哲为论文第一作者,亚热带生态所研究员谭支良、王敏及自然资源部第三海洋研究所研究员董西洋为论文共同通讯作者。研究得到国家自然科学基金和国家重点研发计划等项目支持。
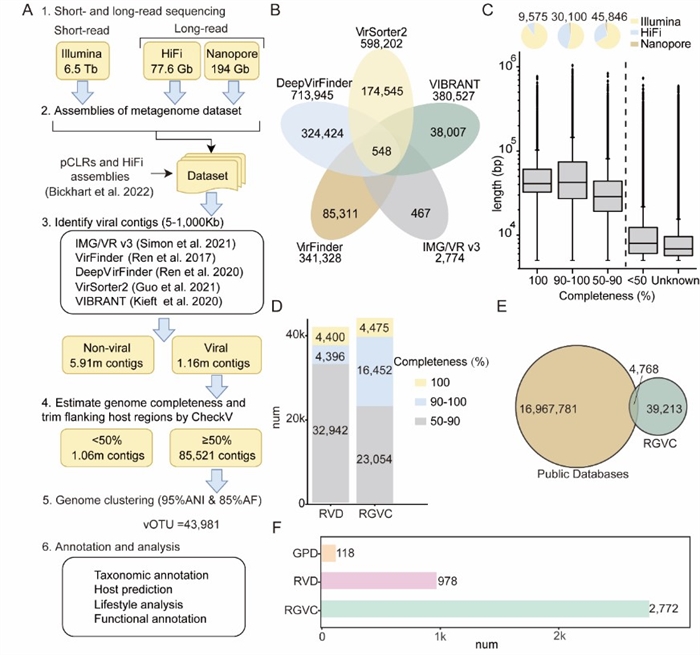
图1 RGVC数据库的构建及特征概述
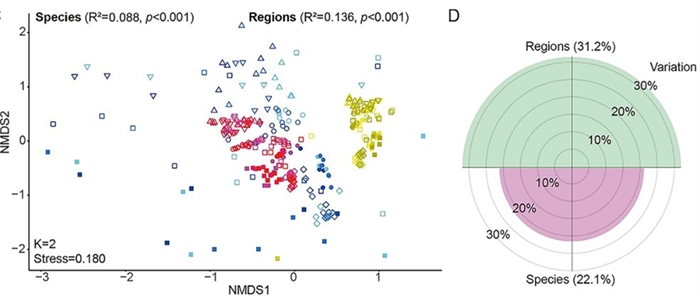
图2 不同胃肠道区域和反刍动物物种的病毒多样性及解释贡献度占比
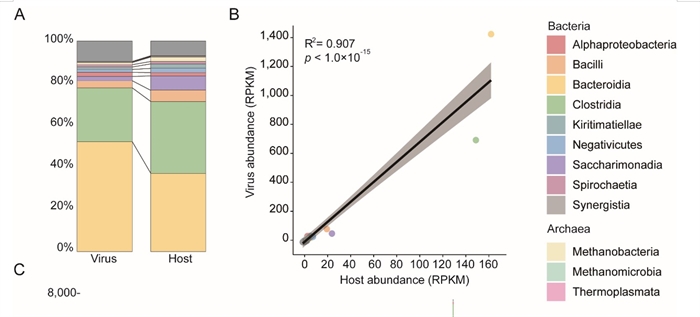
图3 病毒及其宿主丰度呈现强烈线性相关关系
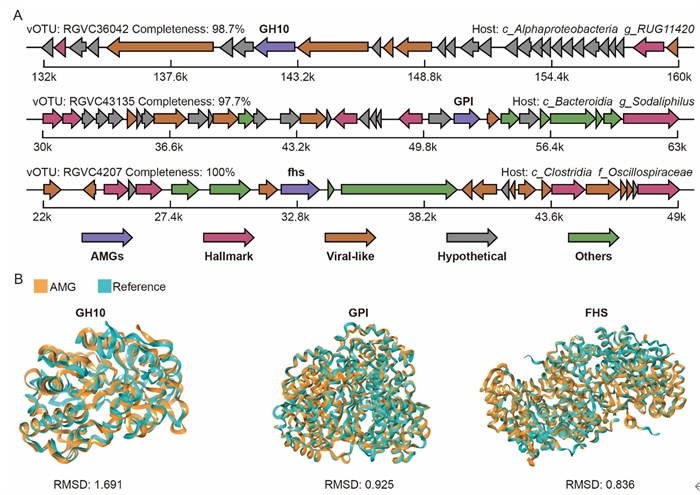
图4 对关键病毒辅助代谢基因的基因组背景和蛋白结构比对验证
附件下载:


